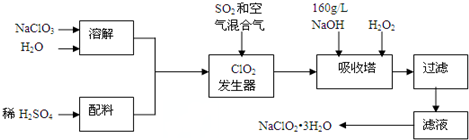
题目内容
2.反应A(g)?2B(?)+C(g)-Q已达到平衡,假设A、C状态始终保持不变,下列说法正确的是( )| A. | 当混合气体的质量不变,说明反应已达到平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体平均相对分子质量不变或增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度可能增大 |
分析 A.B的状态不知道,不能根据混合气体的质量判断平衡状态;
B.若B为气体,增大压强,平衡逆向移动;
C.该反应为吸热反应,升高温度正向移动;
D.该反应为吸热反应,升高温度正向移动,结合B的状态判断.
解答 解:A.若B为气体,则反应过程中气体的总质量始终不变,不能根据总质量判断平衡状态,故A错误;
B.若B为气体,缩小容器体积,则增大压强,平衡逆向移动,气体的物质的量减小,所以气体平均相对分子质量增大,若B为固体,则缩小容器的体积,平衡不移动,即气体平均相对分子质量不变,故B正确;
C.该反应为吸热反应,升高温度正向移动,C的物质的量增大,则气体混合物中C%增大,故C错误;
D.该反应为吸热反应,升高温度正向移动,若B为气体,气体的总质量不变,则气体的密度不变,若B为固体,则气体的总质量减小,所以密度减小,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素、化学平衡状态的判断,题目难度不大,注意把握浓度、温度、压强等对化学平衡的影响以及化学平衡状态的判断方法.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
13.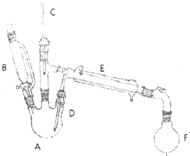 溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
主反应:
NaBr+H2SO4$\stackrel{△}{→}$HBr+NaHSO4
C2H5OH+HBr$\stackrel{△}{→}$C2H5Br+H2O
副反应:在该实验中经常会有乙醚、溴等副产物生成.
实验步骤:
①向A中先加入5mL 95%的无水乙醇(0.085mol)和4.5mL的水,加入溴化钠7.725g,再加入沸石,摇匀.在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中.
②在B中加入9.5mL浓硫酸(0.17mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g.
回答问题:
(1)仪器A的名称为三颈烧瓶
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是溴乙烷沸点低、极易挥发,冰水主要可以防止溴乙烷的挥发饱和亚硫酸氢钠溶液的作用是除去反应中的副产物溴
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有abd(填标号).
a.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 d.减少因浓硫酸氧化HBr而生成副产物溴
(4)步骤③中分出馏出液中有机层的操作名称为分液;:加入浓硫酸除杂后的溶液明显分层,粗产物在上层(填“上”或“下”).
(5)本实验的产率为64%.
 溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:主反应:
NaBr+H2SO4$\stackrel{△}{→}$HBr+NaHSO4
C2H5OH+HBr$\stackrel{△}{→}$C2H5Br+H2O
副反应:在该实验中经常会有乙醚、溴等副产物生成.
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
①向A中先加入5mL 95%的无水乙醇(0.085mol)和4.5mL的水,加入溴化钠7.725g,再加入沸石,摇匀.在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中.
②在B中加入9.5mL浓硫酸(0.17mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g.
回答问题:
(1)仪器A的名称为三颈烧瓶
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是溴乙烷沸点低、极易挥发,冰水主要可以防止溴乙烷的挥发饱和亚硫酸氢钠溶液的作用是除去反应中的副产物溴
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有abd(填标号).
a.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 d.减少因浓硫酸氧化HBr而生成副产物溴
(4)步骤③中分出馏出液中有机层的操作名称为分液;:加入浓硫酸除杂后的溶液明显分层,粗产物在上层(填“上”或“下”).
(5)本实验的产率为64%.
17.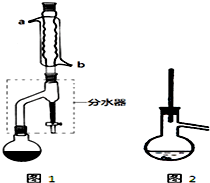 有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:
Ⅰ合成:
在干燥的圆底烧瓶中加入11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水、10mL 10% 碳酸钠溶液洗至中性,充分振荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥.
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.
主要试剂及产物的物理常数如下:
制备过程中还可能有的副反应:
2CH3CH2CH2CH2OH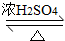 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
(1)合成和分离过程中均使用沸石,其作用防止液体加热时发生暴沸.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在BD中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃)
C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点分水器中水面不再升高.
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的利用率约为88%.
 有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:Ⅰ合成:
在干燥的圆底烧瓶中加入11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水、10mL 10% 碳酸钠溶液洗至中性,充分振荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥.
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.
主要试剂及产物的物理常数如下:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
2CH3CH2CH2CH2OH
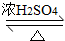 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O(1)合成和分离过程中均使用沸石,其作用防止液体加热时发生暴沸.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在BD中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃)
C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点分水器中水面不再升高.
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的利用率约为88%.
7.当电解质溶液为氢氧化钾水溶液的甲烷燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |
14.下列说法中,能说明化学平衡一定向正反应方向移动的是( )
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
11.下列说法不正确的是( )
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
12. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从表图中选择称量NaOH固体所需要的仪器(填序号)abe.
Ⅱ.测定中和热的实验装置如图所示
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如下表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从表图中选择称量NaOH固体所需要的仪器(填序号)abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如下表.
①请填写下表中的空白:
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.