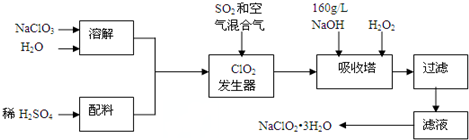
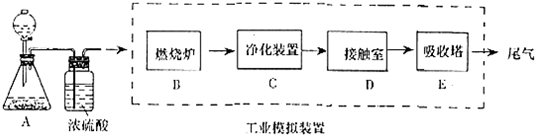
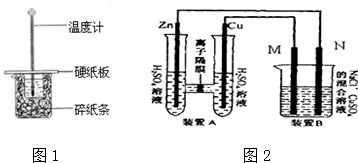
题目内容
19.已知NO2为红棕色气体,而N2O4为无色气体,某温度下,反应N2O4(g)?2NO2(g);△H>0.在密闭容器中达到平衡,下列说法正确的是( )| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
分析 A.缩小容器体积,平衡逆移,NO2浓度增大;
B.保持容器体积不变,加入少许NO2,压强增大;
C.加入少许N2O4,平衡正移,NO2浓度增大;
D.浓度越大速率越大.
解答 解:A.缩小容器体积,平衡逆移,NO2体积分数减小,但是NO2浓度增大,所以混合气体颜色变深,故A错误;
B.保持容器体积不变,加入少许NO2,压强增大,重新达到平衡时,与原平衡相比较,平衡逆向移动,则NO2的体积分数减小,故B错误;
C.保持容器体积不变,加入少许N2O4,平衡正移,NO2浓度增大,所以气体颜色变深,故C正确;
D.保持容器体积不变,加入少许NO2,反应物的浓度增大,则反应速率增大,故D错误.
故选C.
点评 本题考查化学平衡、反应速率的影响因素,把握温度、浓度、压强对反应速率及平衡的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.当电解质溶液为氢氧化钾水溶液的甲烷燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |
14.下列说法中,能说明化学平衡一定向正反应方向移动的是( )
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
11.下列说法不正确的是( )
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |