题目内容
6.金属在化工生产及日常生活中有着广泛的应用,如铁、铬、镓等在现代工业中备受青睐.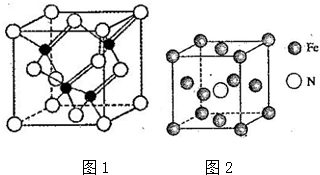
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢.基态Cr原子中,未成对电子数有6个,Cr3+的价电子排布式为3d3.
(2)Zn与Ga的第一电离能从大到小的顺序为Zn>Ga.
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图1所示(白色球代表As原子).在GaAs晶体中,距离每个Ga原子最近的As原子有4个,距离每个As原子最近的As原子有12个.
(4)与As同主族的短周期元素是N、PO、AsH3 空间构型为三角锥形;一定压强下将AsH3和NH3、PH3的混合气体降温时首先液化的是NH3,理由是因为氨分子间存在氢键,分子间作用力更大,沸点更高,降温时先液化.
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图2所示,则氮化铁的化学为Fe4N;设晶胞边长为acm.,阿伏加德罗常数为NA,该晶体的密度为$\frac{238}{{a}^{3}{N}_{A}}$ g•cm-3(用含2和比的式子表示).
分析 (1)基态Cr原子核外有24个电子,3d能级上有5个电子、4s能级上有1个电子,这六个电子都未成,Cr原子失去4s能级上1个电子、3d能级上2个电子生成Cr3+,该离子3d能级上电子为其价电子;
(2)原子轨道中电子处于半满、全满、全空时最稳定,原子越稳定,其第一电离能越大;
(3)在GaAs晶体中,距离每个Ga原子最近的As原子有4个,距离每个As原子最近的As原子个数=3×8÷2;
(4)与As同主族的短周期元素是N、P,所经AsH3的结构应与NH3相似,NH3分子之间有氢键,沸点较高;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为1×$\frac{1}{8}$+6×$\frac{1}{2}$=4,进而确定氮化铁的化学式,根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)基态Cr原子核外有24个电子,3d能级上有5个电子、4s能级上有1个电子,这六个电子都未成,Cr原子失去4s能级上1个电子、3d能级上2个电子生成Cr3+,该离子3d能级上电子为其价电子,所以其价电子排布式为3d3,故答案为:6;3d3;
(2)原子轨道中电子处于半满、全满、全空时最稳定,原子越稳定,其第一电离能越大,Zn原子各个轨道上电子处于全满,Ga原子4p轨道上只有一个电子,所以第一电离能Zn>Ga,故答案为:Zn>Ga;
(3)在GaAs晶体中,距离每个Ga原子最近的As原子有4个,距离每个As原子最近的As原子个数=3×8÷2=12,
故答案为:4;12;
(4)氨分子中氮原子按sp3方式杂化,N与As同主族,所经AsH3的结构应与NH3相似,AsH3中心原子杂化的类型为sp3,为三角锥形结构,NH3分子之间有氢键,沸点较高,所以一定压强下将AsH3和NH3.PH3的混合气体降温是首先液化的是NH3,
故答案为:三角锥形;NH3;氨分子间存在氢键,分子间作用力更大,沸点更高,降温时先液化;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为1×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮化铁的化学式为Fe4N,晶胞的体积为a3cm3,所以ρ=$\frac{m}{V}$=$\frac{\frac{56×4+14}{{N}_{A}}}{{a}^{3}}$g•cm-3=$\frac{238}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:Fe4N;$\frac{238}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、微粒空间构型判断、氢键等知识点,侧重考查学生知识综合应用、空间想象及计算能力,难点是晶胞计算,注意氢键只影响熔沸点而不影响氢化物稳定性.

| A. | 相同条件下,平衡时若充入稀有气体,SO2的转化率增大 | |
| B. | 0~6 min的平衡反应速率:v(O2)=0.105 mol/(L•min) | |
| C. | 保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 反应开始时,向容器中通入的SO2的物质的量是1.4 mol |
 有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:Ⅰ合成:
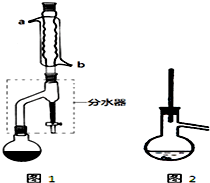
在干燥的圆底烧瓶中加入11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水、10mL 10% 碳酸钠溶液洗至中性,充分振荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥.
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.
主要试剂及产物的物理常数如下:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
2CH3CH2CH2CH2OH
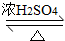 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O(1)合成和分离过程中均使用沸石,其作用防止液体加热时发生暴沸.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在BD中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃)
C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点分水器中水面不再升高.
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的利用率约为88%.
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
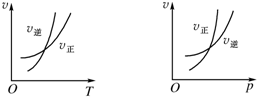 可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )| A. | m<n+p,Q>0 | B. | m>n+p,Q>0 | C. | m<n+p,Q<0 | D. | m>n+p,Q<0 |
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
| A. | 它们的原子核外电子层数随质子数的增加而增多 | |
| B. | 它们的L层电子数都相同 | |
| C. | 它们的原子核对最外层电子的引力逐渐减弱 | |
| D. | 它们与氧气或水反应时越来越剧烈 |
| A. | K1=K2 | B. | K1<K2 | C. | K1>K2 | D. | 无法确定 |
| A. | ${\;}_{8}^{17}O$原子核内含有8个中子 | B. | ${\;}_{8}^{17}O$原子核内含有8个质子 | ||
| C. | ${\;}_{8}^{17}O$原子核外有17个电子 | D. | ${\;}_{8}^{17}O$原子核内含有17个质子 |