题目内容
在2L密闭容器内,进行反应N2(g)+3H2(g)?2NH3(g).下列能说明反应已达到平衡的是( )
| A、容器内气体密度保持不变 |
| B、v正(N2)=3 v逆(H2) |
| C、混合气体平均相对分子质量不变 |
| D、氨气的浓度是氮气浓度的2倍 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:A、气体密度始终保持不变,故A错误;
B、v正(N2)=
v正(H2)=3 v逆(H2),正逆反应速率不等,故B错误;
C、气体的总质量不变,混合气体平均相对分子质量不变,说明物质的量不变,反应达平衡状态,故C正确;
D、氨气的浓度是氮气浓度的2倍,并不是不变,故D错误;
故选:C.
B、v正(N2)=
| 1 |
| 3 |
C、气体的总质量不变,混合气体平均相对分子质量不变,说明物质的量不变,反应达平衡状态,故C正确;
D、氨气的浓度是氮气浓度的2倍,并不是不变,故D错误;
故选:C.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、0.2mol/LNa2CO3溶液中所含CO32-的数目为0.2NA |
| B、常温常压下,5.6g乙烯与丁烯的混合物中含有的氢原子的数目为0.8NA |
| C、50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D、22.4LCO2与足量Na2O2充分反应,反应中转移的电子数目为NA |
制玻璃、制水泥二种工业生产中,都需要的原料是( )
| A、纯碱 | B、石灰石 | C、石英 | D、黏土 |
已知:H2O(g)═H2O(l)△H=Q1 kJ?mol-1C2H5OH(g)═C2H5OH(l)△H=Q2 kJ?mol-1C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3 kJ?mol-1若使46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
| A、(Q1+Q2+Q3)kJ |
| B、0.5(Q1+Q2+Q3)kJ |
| C、(0.5Q1-1.5Q2+0.5Q3)kJ |
| D、(3Q1-Q2+Q3)kJ |

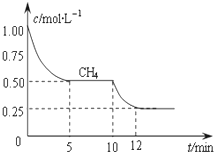 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有: