��Ŀ����
 �ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϣ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
�ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϣ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У���CH4��g��+H2O��g��?CO��g��+3H2��g����H1=+206.1kJ/mol
��CH4��g��+CO2��g��?2CO��g��+2H2��g����H2=+247.3kJ/mol
��CO��g��+H2O��g��?CO2��g��+H2��g����H3
��ش��������⣺
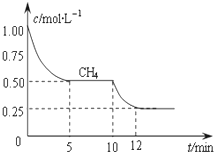
��1����һ�ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ����Ӧ���е�ǰ5min�ڣ�v��H2��=
��2����Ӧ���С�H3=
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
A��v��������v���棩 B��v��������v���棩 C��v������=v���棩 D�����жϣ�
���㣺�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧƽ���Ӱ������
ר�⣺��ѧ��Ӧ�е������仯,��ѧƽ��ר��
��������1������ͼ��֪��ǰ5min�ڼ����Ũ����1.00mol/L��СΪ0.50mol/L���Դ˼���v��H2������ͼ��֪��10minʱ�����Ũ�ȼ�����С���÷�Ӧ������Ӧ�����ƶ���
��2���ס����������зֱ��������ʵ�����CH4��CO2���Ҽס�����������ʼ�ݻ���ȣ���ͼ��֪����������䣬�ҵ�ѹǿ���䣬��ٶ��ײ��䣬���з���CH4+CO2?2CO+2H2��������������൱��ѹǿ��С����ѧƽ��������Ӧ�����ƶ�����������CH4��ת��������ѹǿС����Ӧ���ʼ�������ﵽƽ���ʱ��䳤��
��3�����ݸ�˹���ɿ�֪����-�ڿɵ÷�Ӧ�ۣ�������Q��K�Ĺ�ϵ�жϷ�Ӧ���еķ��Ӷ�ȷ�����淴Ӧ���ʵĹ�ϵ��
��2���ס����������зֱ��������ʵ�����CH4��CO2���Ҽס�����������ʼ�ݻ���ȣ���ͼ��֪����������䣬�ҵ�ѹǿ���䣬��ٶ��ײ��䣬���з���CH4+CO2?2CO+2H2��������������൱��ѹǿ��С����ѧƽ��������Ӧ�����ƶ�����������CH4��ת��������ѹǿС����Ӧ���ʼ�������ﵽƽ���ʱ��䳤��
��3�����ݸ�˹���ɿ�֪����-�ڿɵ÷�Ӧ�ۣ�������Q��K�Ĺ�ϵ�жϷ�Ӧ���еķ��Ӷ�ȷ�����淴Ӧ���ʵĹ�ϵ��
���
�⣺��1������ͼ��֪��ǰ5min�ڼ����Ũ����1.00mol/L��СΪ0.50mol/L����v��CH4��=
=0.1mol/��L?min�����ɻ�ѧ������֮�ȵ��ڷ�Ӧ����֮�ȣ���v��H2��=3��0.1mol/��L?min��=0.3mol/��L?min������ͼ��֪��10minʱ�����Ũ�ȼ�����С���ҷ�Ӧ�������÷�Ӧ������Ӧ�����ƶ������÷�ӦΪ���ȷ�Ӧ���������¶ȷ������⣬
�ʴ�Ϊ��0.3 mol/��L?min���������¶ȣ�
��2�����ݸ�˹���ɿ�֪����-�ڿɵ÷�Ӧ�ۣ����H3=+206.1kJ/mol-��+247.3kJ/mol��=-41.2kJ/mol��
800��ʱ����Ӧ�۵�K=1.0ʱ�����淴Ӧ������ȣ���ѧƽ�ⲻ�ƶ���
�ɱ����е����ݿ�֪������������ͬ�������ʵ�����Ũ�ȳ����ȣ�Q=
��K=1.0���÷�Ӧ������Ӧ�����ƶ���������Ӧ���ʴ����淴Ӧ���ʣ���ѡA��
�ʴ�Ϊ��-41.2 kJ/mol��A��
| 1.00mol/L-0.50mol/L |
| 5min |
�ʴ�Ϊ��0.3 mol/��L?min���������¶ȣ�
��2�����ݸ�˹���ɿ�֪����-�ڿɵ÷�Ӧ�ۣ����H3=+206.1kJ/mol-��+247.3kJ/mol��=-41.2kJ/mol��
800��ʱ����Ӧ�۵�K=1.0ʱ�����淴Ӧ������ȣ���ѧƽ�ⲻ�ƶ���
�ɱ����е����ݿ�֪������������ͬ�������ʵ�����Ũ�ȳ����ȣ�Q=
| 2.0��2.0 |
| 0.5��8.5 |
�ʴ�Ϊ��-41.2 kJ/mol��A��
���������⿼�黯ѧ��Ӧ���ʵļ��㣬��ѧƽ����ƶ�����Ӧ������жϣ��Ѷ�һ�㣬��2����ѧ������е��ѵ㣬ע�����ú�Ũ������K�Ĺ�ϵ�����

��ϰ��ϵ�д�
�����Ŀ
��NA��ʾ�����ӵ����������������в���ȷ���ǣ�������
| A��31g�������������ף����������ʵĺ�����Ʒ�У�������NA����ԭ�� |
| B������1mol�Ȼ�����ȫת��Ϊ�����������壬���ɢϵ�н�������С��NA |
| C��1molNa2O2��ˮ��Ӧת�Ƶĵ�����ΪNA |
| D��58.5g���Ȼ��ƹ����к���NA���Ȼ��Ʒ��� |
��֪A��g��+B��g���TC��g����H1��D��g��+B��g���TE��g����H2����A��D�������1mol��B��ȫ��Ӧ����Ӧ��Ϊ��H3����A��D���ʵ���֮��Ϊ��������
A��
| ||
B��
| ||
C��
| ||
D��
|
��֪����2C��s��+O2��g���T2CO��g����H=-221.0kJ?mol-1��
��2H2��g��+O2��g���T2H2O��g����H=-483.6kJ?mol-1��
���Ʊ�ˮú���ķ�ӦC��s��+H2O��g���TCO��g��+H2��g���ġ�HΪ��������
��2H2��g��+O2��g���T2H2O��g����H=-483.6kJ?mol-1��
���Ʊ�ˮú���ķ�ӦC��s��+H2O��g���TCO��g��+H2��g���ġ�HΪ��������
| A��262.6 kJ?mol-1 |
| B��-131.3 kJ?mol-1 |
| C��-352.3 kJ?mol-1 |
| D��131.3 kJ?mol-1 |
��2L�ܱ������ڣ����з�ӦN2��g��+3H2��g��?2NH3��g����������˵����Ӧ�Ѵﵽƽ����ǣ�������
| A�������������ܶȱ��ֲ��� |
| B��v����N2��=3 v����H2�� |
| C���������ƽ����Է����������� |
| D��������Ũ���ǵ���Ũ�ȵ�2�� |
��Mg��OH��2��ˮ�дﵽ�ܽ�ƽ��ʱ��Mg��OH��2��s��?Mg2+��aq��+2OH-��aq��ҪʹMg��OH��2��һ���ܽ⣬Ӧ����Һ�м������Ĺ����ǣ�������
| A��NH4Cl |
| B��NaOH |
| C��Na2CO3 |
| D��Fe |
���й���ʵ������������һ���ǣ�������
| A��ȡ5mL 0.1mol/L KI��Һ���μ�0.1mol/L FeCl3��Һ5��6�Σ���������2mL CCl4�������ȡ�ϲ���Һ���μ�KSCN��Һ����Һ����Ѫ��ɫ��֤����Һ�л�����Fe3+ |
| B�������������ⸯʴʵ���У��ڸ�����Χ����K3[Fe��CN��6]��Һ�������ɫ���� |
| C��ȼ�ϵ��ʵ���У���KNO3��Һ��Na2SO4��Һ��������ˮ��Ч��Ҫ�õö� |
| D�����ǵġ��������ʵ����ֻ������Ũ�������ˮ�� |
��֪25��ʱһЩ�������ʵ��ܶȻ��������£�
�����ϱ����ݣ��ж����л�ѧ����ʽ����ȷ���ǣ�������
| ��ѧʽ | Zn��OH��2 | ZnS | AgCl | Ag2S | MgCO3 | Mg��OH��2 |
| �ܶȻ� | 5��10-17 | 2.5��10-22 | 1.8��10-10 | 6.3��10-50 | 6.8��10-6 | 1.8��10-11 |
| A��2AgCl+Na2S�T2NaCl+Ag2S | ||||
B��MgCO3+H2O
| ||||
| C��ZnS+2H2O�TZn��OH��2+H2S�� | ||||
| D��Mg��HCO3��2+2Ca��OH��2�TMg��OH��2��+2CaCO3��+2H2O |
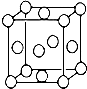 ij��λ������Ϊ����ɫ���壬��ԭ���������������A��B��C��D��E����Ԫ����ɣ���ԭ�Ӹ�����Ϊl4��4��5��1��1�� ����C��DԪ��ͬ������ԭ������DΪC�Ķ�����EԪ�ص���Χ�����Ų�Ϊ��n-1��dn+6nsl���ش��������⣮
ij��λ������Ϊ����ɫ���壬��ԭ���������������A��B��C��D��E����Ԫ����ɣ���ԭ�Ӹ�����Ϊl4��4��5��1��1�� ����C��DԪ��ͬ������ԭ������DΪC�Ķ�����EԪ�ص���Χ�����Ų�Ϊ��n-1��dn+6nsl���ش��������⣮