题目内容
随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.
(1)已知CH3OH(g)+
O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol又知H2O(l)=H2O(g)△H=+44kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 .
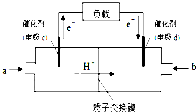
(2)如图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图.甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.则c电极是 (填“正极”或“负极”),c电极上发生的电极反应式是 .

(3)将上述甲醇质子交换膜燃料电池连接惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu (OH)2后恰好恢复到电解前的浓度.则电解过程中转移的电子数为 个.
(4)若某反应为:Cu+2H2O=Cu(OH)2+H2↑,请判断该反应属于原电池反应还是电解池反应,将装置图画在右边方框中.
(1)已知CH3OH(g)+
| 3 |
| 2 |
(2)如图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图.甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.则c电极是


(3)将上述甲醇质子交换膜燃料电池连接惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu (OH)2后恰好恢复到电解前的浓度.则电解过程中转移的电子数为
(4)若某反应为:Cu+2H2O=Cu(OH)2+H2↑,请判断该反应属于原电池反应还是电解池反应,将装置图画在右边方框中.
考点:用盖斯定律进行有关反应热的计算,电极反应和电池反应方程式,电解原理
专题:化学反应中的能量变化,电化学专题
分析:(1)32g的CH3OH的物质的量为1mol,结合盖斯定律计算;
(2)原电池中电子从负极经外电路流向正极,负极反应氧化反应;
(3)根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电;
(4)铜和盐酸或硫酸不反应,和硝酸反应不生成氢气,所以该反应不是自发的进行氧化还原反应,该装置是电解池;铜作阳极,电解质溶液为酸.
(2)原电池中电子从负极经外电路流向正极,负极反应氧化反应;
(3)根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电;
(4)铜和盐酸或硫酸不反应,和硝酸反应不生成氢气,所以该反应不是自发的进行氧化还原反应,该装置是电解池;铜作阳极,电解质溶液为酸.
解答:
解:(1)已知①CH3OH(g)+
O2=CO2(g)+2H2O(g)△H=-192.9KJ/mol,②H2O(l)=H2O(g)△=44KJ/mol,
利用盖斯定律将①-②×2可得CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)
△H=(-192.9kJ/mol)-44KJ/mol×2=-280.9kJ/mol,
故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知c电极为负极,
甲醇在负极上发生氧化反应,电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:负极;CH3OH-6e-+H2O=CO2+6H+;
(3)Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度,即电解生成了0.1 mol H2SO4 ,并电解了0.1 mol H2O ,由电解的总反应式:
2H2O+?2CuSO4
2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.1mol 0.2mol
2H2O
2H2↑+O2↑ 转移电子
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4 mol,故答案:0.4NA;
(4)铜和硫酸反应中,该反应不能自发进行,所以选择电解池,失电子的是金属铜,金属Cu一定做阳极,电解质为硫酸,即 ,
,
故答案为:电解池; .
.
| 3 |
| 2 |
利用盖斯定律将①-②×2可得CH3OH(g)+
| 3 |
| 2 |
△H=(-192.9kJ/mol)-44KJ/mol×2=-280.9kJ/mol,
故答案为:CH3OH(g)+
| 3 |
| 2 |
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知c电极为负极,
甲醇在负极上发生氧化反应,电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:负极;CH3OH-6e-+H2O=CO2+6H+;
(3)Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度,即电解生成了0.1 mol H2SO4 ,并电解了0.1 mol H2O ,由电解的总反应式:
2H2O+?2CuSO4
| ||
2mol 4mol
0.1mol 0.2mol
2H2O
| ||
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4 mol,故答案:0.4NA;
(4)铜和硫酸反应中,该反应不能自发进行,所以选择电解池,失电子的是金属铜,金属Cu一定做阳极,电解质为硫酸,即
 ,
,故答案为:电解池;
 .
.
点评:本题主要考查了盖斯定律的应用、电化学中电极方程式的书写及其计算,关键要在理解燃料电池盒电解池原理的基础上进行解题,题目难度不大.

练习册系列答案
相关题目
化学概念是对化学现象与事实的总结和概括.下列说法中正确的是( )
| A、分散系只包括溶液和胶体 |
| B、电解质和非电解质构成所有的物质 |
| C、相同体积的两溶液,物质的量浓度大的溶液含有溶质的质量就越大 |
| D、单位物质的量的物质所具有的质量叫摩尔质量,摩尔质量与1mol物质的质量数值相同 |
已知A(g)+B(g)═C(g)△H1,D(g)+B(g)═E(g)△H2.若A和D混合气体1mol与B完全反应,反应热为△H3,则A和D物质的量之比为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
已知:①2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1;
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1.
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1.
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
| A、262.6 kJ?mol-1 |
| B、-131.3 kJ?mol-1 |
| C、-352.3 kJ?mol-1 |
| D、131.3 kJ?mol-1 |
在2L密闭容器内,进行反应N2(g)+3H2(g)?2NH3(g).下列能说明反应已达到平衡的是( )
| A、容器内气体密度保持不变 |
| B、v正(N2)=3 v逆(H2) |
| C、混合气体平均相对分子质量不变 |
| D、氨气的浓度是氮气浓度的2倍 |
下列关于实验的描述错误的一项是( )
| A、取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,继续加入2mL CCl4,充分振荡,取上层溶液,滴加KSCN溶液,溶液呈现血红色,证明溶液中还存在Fe3+ |
| B、在铁钉的析氢腐蚀实验中,在负极周围加入K3[Fe(CN)6]溶液会出现蓝色沉淀 |
| C、燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
| D、蔗糖的“黑面包”实验中只体现了浓硫酸的脱水性 |