题目内容
11.0.012kg13C所含原子数为阿伏加德罗常数.× (判断对错)分析 0.012kg12C中所含的碳原子数为阿伏加德罗常数,以此解答该题.
解答 解:0.012kg12C中所含的碳原子数为阿伏加德罗常数,而不是13C,故答案为:×.
点评 本题考查了阿伏伽德罗常数,题目难度不大,注意明确阿伏伽德罗常数的含义及阿伏伽德罗常数与6.02×1023关系,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
1.已知NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下2.2gCO2中含有共用电子对的数目为2NA | |
| B. | 标准状况下,11.2L苯中含的碳原子数为3NA | |
| C. | 25℃时,0.1mol/L的一元强酸HA中,H+的个数为0.1NA | |
| D. | 6.4gCu与一定浓度的HNO3完全反应得到混合气体,则反应转移的电子数为0.2NA |
2.下列反应的离子方程式中,书写正确的是( )
| A. | 硝酸银溶液跟铜反应 Cu+Ag+=Cu2++Ag | |
| B. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 钠跟水反应 2 Na+2H2O=2 Na++2OH-+H2↑ | |
| D. | 碳酸钙跟盐酸反应CO32-+2H+=H2O+CO2↑ |
3.一定量的盐酸跟少量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入( )
| A. | KNO3溶液 | B. | NaCl溶液 | C. | 铜粉 | D. | 硫酸铜晶体 |
20.为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)
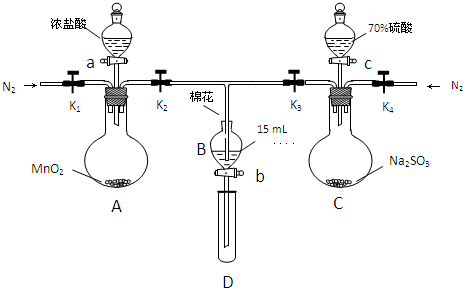
实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程IV,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的氧气
(2)棉花中浸润的溶液为氢氧化钠溶液
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
(4)用70%的硫酸支取SO2,反应速率比用98%的硫酸块,原因是70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是取少量B溶液于试管中,加入足量的稀盐酸酸化,在滴加几滴氯化钡溶液,若有白色沉淀生成,证明溶液B中有硫酸根
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是乙丙
(7)进行实验过程Ⅴ时,B中的溶液颜色由黄色变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色.
查阅资料:Fe2+(aq)+SO32-(aq)?FeSO3(s)
提出假设:FeCl3和SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合颜色.
某同学设计如下实验,证实该假设的成立:
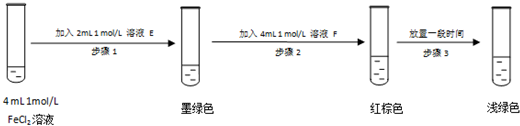
溶液E和F分别是Na2SO3溶液、FeCl3溶液
请用化学平衡原理解释步骤3红棕色溶液变为浅绿色的原因反应2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,促使Fe3++3H2O Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.

实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程IV,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的氧气
(2)棉花中浸润的溶液为氢氧化钠溶液
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
(4)用70%的硫酸支取SO2,反应速率比用98%的硫酸块,原因是70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是取少量B溶液于试管中,加入足量的稀盐酸酸化,在滴加几滴氯化钡溶液,若有白色沉淀生成,证明溶液B中有硫酸根
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是乙丙
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+SO32-(aq)?FeSO3(s)
提出假设:FeCl3和SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合颜色.
某同学设计如下实验,证实该假设的成立:

溶液E和F分别是Na2SO3溶液、FeCl3溶液
请用化学平衡原理解释步骤3红棕色溶液变为浅绿色的原因反应2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,促使Fe3++3H2O
 Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.
1.下列说法正确的是( )
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物CaCl2中,两个氯离子之间也存在离子键 | |
| C. | 分子中只有共价键的化合物一定是共价化合物 | |
| D. | 不同元素组成的多原子分子中的化学键一定为极性键 |