题目内容
3.一定量的盐酸跟少量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入( )| A. | KNO3溶液 | B. | NaCl溶液 | C. | 铜粉 | D. | 硫酸铜晶体 |
分析 铁与盐酸反应本质为Fe+2H+=Fe2++H2↑,一定量的盐酸跟少量的铁粉反应,铁粉不足,减缓反应速率但不影响生成H2的总量,应降低H+浓度,但不能影响与酸反应生成氢气的铁粉的质量,结合物质的性质解答.
解答 解:A、加入KNO3溶液后,在酸性溶液中NO3-和铁反应生成的气体不会是氢气,故A错误;
B、NaCl溶液不参与反应,但溶液体积增大,会降低盐酸的浓度,反应速率降低,故B正确;
C、加入铜粉,可构成原电池加快反应速率,故C错误;
D、加入硫酸铜晶体后,铁可置换出铜,构成原电池,加快反应,故B错误.
故选B.
点评 考查反应速率的影响因素,难度中等,注意A中加入后硝酸反应完毕,剩余的铁与盐酸反应生成氢气.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
13.下列比较不正确的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 碱性:KOH>NaOH | ||
| C. | 原子半径:S<Cl | D. | 稳定性:NH3>CH4 |
14.下列说法正确的是( )
| A. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| C. | SO2、SiO2、CO均为酸性氧化物 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
8.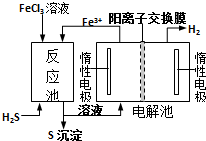 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液,吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液,吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中正确的是( )
 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液,吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液,吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中正确的是( )| A. | 电解池中OH-从右槽迁移到左槽 | |
| B. | H+在右槽发生氧化反应 | |
| C. | 左槽中发生的反应是:4OH--4e-═O2↑+2H2O | |
| D. | 常温常压下,反应中每转移1mol电子生成1g氢气 |
12.美国“海狼”潜艇上的核反应堆内使用了液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
| A. | 原子半径:Na>Al | |
| B. | 若把铝钠合金投入一定量的水中只得到无色溶液,则n(Al)≤n(Na) | |
| C. | m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀生成 |
13.收藏家收藏的清末铝制品,至今仍保存完好,其主要原因是( )
| A. | 铝不易发生化学反应 | |
| B. | 铝的氧化物容易发生还原反应 | |
| C. | 铝不易被氧气氧化 | |
| D. | 铝表面致密的氧化膜能阻止铝进一步被氧化 |