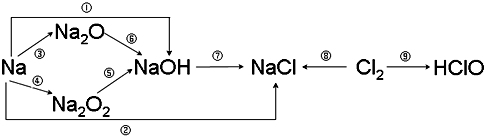
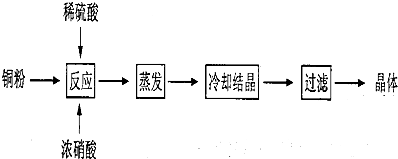
题目内容
7.下列说法正确的是( )| A. | 往NaHC2O4溶液中通入氨气至中性:c(H2C2O4)+c(NH4+)>c(C2O42-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小 | |
| C. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后过滤,所得滤液中存在:c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | 在同浓度的HCN和NaCN的混合溶液中,若pH>7,则c(HCN)<c(Na+) |
分析 A.根据反应后溶液中的电荷守恒和物料守恒判断;
B.稀释过程中醋酸的物质的量减小、氢离子的物质的量增大,结合在同一溶液中判断该比值;
C.溶液中存在电荷守恒c(Na+)+c(H+)+c(NH4+)=c(Cl-)+c(OH-)+c(HCO3-)+2c(CO32-),滤液中溶质为氯化铵和氯化钠,钠离子浓度大于氯离子;
D.同浓度的HCN和NaCN的混合溶液中,若pH>7,说明CN-的水解程度大于HCN的电离程度,则c(CN-)<c(HCN),结合物料守恒判断c(HCN)、c(Na+)的大小.
解答 解:A.中性溶液中c(H+)=c(OH-),根据电荷守恒可得:①c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-),根据物料守恒可得②c(H2C2O4)+c(HC2O4-)+c(C2O42-)=c(Na+),根据①②结合可得:c(H2C2O4)+c(NH4+)=c(C2O42-),故A错误;
B.将pH=a的醋酸稀释为pH=a+1的过程中,醋酸的电离程度增大,醋酸的物质的量减小、氢离子的物质的量增大,同一溶液中浓度之比等于物质的量之比,则c(CH3COOH)/c(H+)会变小,故B正确;
C.滤液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(Cl-)+c(OH-)+c(HCO3-)+2c(CO32-),由于滤液中溶质为氯化铵和NaCl,则c(Na+)<c(Cl-),所以c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D.相同浓度的NaCN与HCN的混合混合液的pH>7,呈碱性,说明CN-的水解程度大于HCN的电离程度,则c(CN-)<c(HCN),根据物料守恒2c(Na+)═c(CN-)+c(HCN)可得:c(HCN)>c(Na+)>c(CN-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒的含义为解答关键,C为易错点,注意滤液中钠离子浓度减小,试题培养了学生的灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(Ⅱ)在10L的密闭容器中,发生如下化学反应:A(g)+B(g)?C(g)+D(g)
其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热(填“吸热”或“放热”)反应.
(2)该反应的化学平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$.
(3)某温度下,将A和B各0.10mol充入该容器中,达到平衡后,测得 c(C)=0.0060mol/L,则A的转化率为60%.
(4)某温度下,平衡浓度符合下式:c(A)•c(B)=c(C)•c(D),试判断此时的温度为830℃.
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(A)为2mol•L-1,c(B)为1.5mol,•L-1,c(C)为1mol•L-1,c(D)为3mol•L-1,则下一时刻,反应将逆向(填“正向”或“逆向”)进行.
| A. | 150mL 2mol•L-1的KCl溶液 | B. | 75mL 4 mol•L-1的NH4Cl溶液 | ||
| C. | 75mL 1.5mol•L-1的MgCl2溶液 | D. | 150mL 1 mol•L-1的NaCl溶液 |
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1mol H-H键和1 mol I-I键所需能量大于断开2mol H-I键所需能量 | |
| C. | 断开2mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2akJ |
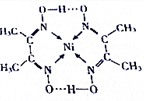 从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:
从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题: