题目内容
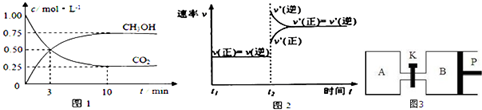
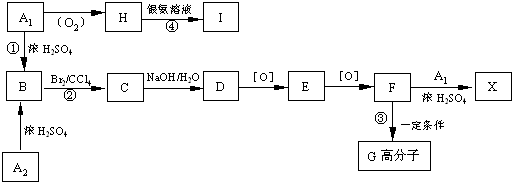
碱式碳酸镁[一般以xMgCO3?yMg(OH)2?zH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应.不溶于乙醇,常温下不会分解,是橡胶制品的优良填料.工艺流程如下图:

(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是: .
②氢氧化镁浆液与CO2反应的化学方程式为: .
③碱式碳酸镁用乙醇洗涤的目的是: .
(2)已知:碱式碳酸镁分解反应方程式为:xMgCO3?yMg(OH)2?zH2O
(x+y)MgO+xCO2↑+(y+z)H2O
某同学将46.6g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为20.0g,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重17.6g.根据实验测定的数据,确定碱式碳酸镁[xMgCO3?yMg(OH)2?zH2O]的化学式(要求写出计算过程).

(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是:
②氢氧化镁浆液与CO2反应的化学方程式为:
③碱式碳酸镁用乙醇洗涤的目的是:
(2)已知:碱式碳酸镁分解反应方程式为:xMgCO3?yMg(OH)2?zH2O
| ||
某同学将46.6g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为20.0g,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重17.6g.根据实验测定的数据,确定碱式碳酸镁[xMgCO3?yMg(OH)2?zH2O]的化学式(要求写出计算过程).
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)①CaCO3高温分解生成CaO和CO2,所以焦炭的作用是:作燃料、提供能量;
②根据流程图,CO2与Mg(OH)2反应后的产物经压滤得到Mg(HCO3)2,所以CO2与Mg(OH)2反应的化学方程式为:Mg(OH)2+2CO2=Mg(HCO3)2;
③因为碱式碳酸镁在水中引起轻微的碱性反应,不溶于乙醇,所以用乙醇洗涤可以除去表面杂质、减少固体的损耗;
(2)残留固体为CaO,碱石灰吸收CO2,质量增加量为CO2的质量,据元素守恒可求解.
②根据流程图,CO2与Mg(OH)2反应后的产物经压滤得到Mg(HCO3)2,所以CO2与Mg(OH)2反应的化学方程式为:Mg(OH)2+2CO2=Mg(HCO3)2;
③因为碱式碳酸镁在水中引起轻微的碱性反应,不溶于乙醇,所以用乙醇洗涤可以除去表面杂质、减少固体的损耗;
(2)残留固体为CaO,碱石灰吸收CO2,质量增加量为CO2的质量,据元素守恒可求解.
解答:
解:(1)①CaCO3高温分解生成CaO和CO2,焦炭作燃料、提供能量,故答案为:作燃料、提供能量;
②CO2与Mg(OH)2反应后的产物经压滤得到反应的化学方程式为Mg(HCO3)2,Mg(OH)2+2CO2=Mg(HCO3)2,
故答案为:Mg(HCO3)2,Mg(OH)2+2CO2=Mg(HCO3)2;
③用乙醇洗涤可以除去表面杂质碱式碳酸镁,减少固体的损耗,故答案为:除去表面杂质、减少固体的损耗;
(2)残留固体为CaO,碱石灰吸收CO2,质量增加量为CO2的质量,可得:
n(Mg2+)=20.0g/40g?mol-1=0.5mol
n(CO2)=17.6g/44g?mol-1=0.4mol
据元素守恒得:
m(MgCO3)=0.4mol×84g?mol-1=33.6g
m[Mg(OH)2]=(0.5mol-0.4mol)=5.8g
n(H2O)=44.6g-33.6g-5.8g/18g?mol-1=0.4mol
x:y:z=4:1:4
则碱式碳酸镁的化学式为:4MgCO3?Mg(OH)2?4H2O,
故答案为:4MgCO3?Mg(OH)2?4H2O.
②CO2与Mg(OH)2反应后的产物经压滤得到反应的化学方程式为Mg(HCO3)2,Mg(OH)2+2CO2=Mg(HCO3)2,
故答案为:Mg(HCO3)2,Mg(OH)2+2CO2=Mg(HCO3)2;
③用乙醇洗涤可以除去表面杂质碱式碳酸镁,减少固体的损耗,故答案为:除去表面杂质、减少固体的损耗;
(2)残留固体为CaO,碱石灰吸收CO2,质量增加量为CO2的质量,可得:
n(Mg2+)=20.0g/40g?mol-1=0.5mol
n(CO2)=17.6g/44g?mol-1=0.4mol
据元素守恒得:
m(MgCO3)=0.4mol×84g?mol-1=33.6g
m[Mg(OH)2]=(0.5mol-0.4mol)=5.8g
n(H2O)=44.6g-33.6g-5.8g/18g?mol-1=0.4mol
x:y:z=4:1:4
则碱式碳酸镁的化学式为:4MgCO3?Mg(OH)2?4H2O,
故答案为:4MgCO3?Mg(OH)2?4H2O.
点评:本题考查化学流程的分析、化学方程式的书写、洗涤方法、化学计算,题目难度较大,试题涉及的内容较多、综合性较强.

练习册系列答案
相关题目
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
| A、未洗涤烧杯和玻璃棒 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、定容时俯视液面 |
普罗加比对瘫痫、痉挛和运动失调均有良好的治疗效果,其结构如图所示,有关普罗加比的说法正确的是( )
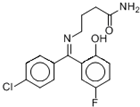

| A、该分子在1H核磁共振谱中有12个峰 |
| B、久置在空气中的普罗加比会因氧化而变质 |
| C、1 mol普罗加比最多可与3 mol NaOH反应 |
| D、一定条件下,1mol普罗加比最多能与2mol H2发生加成反应 |
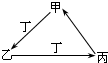 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为Fe,则丁可能是Cl2 |
| C、若甲为AlCl3,则丁可能是NH3 |
| D、若甲为NaHCO3,则丁可能是HCl |