题目内容
19.元素X与元素Y在周期表中位于相邻的两个周期,X与Y两原子核外电子数之和为19,Y原子核内质子数比X多3个.下列描述正确的是( )| A. | X和Y都是性质活泼的元素,在自然界中只能以化合态存在 | |
| B. | X和Y形成的化合物的化学式只能为Y2X2 | |
| C. | X的化合物种类比Y的化合物种类多 | |
| D. | Y能置换酸中氢放出氢气,但不能置换盐中的金属 |
分析 元素X和元素Y在周期表中位于相邻的两个周期:X与Y两原子核外电子总数之和为19,则为短周期元素,且位于二、三周期,设X原子的质子数为m,Y原子的质子数为n,则有:$\left\{\begin{array}{l}{m+n=19}\\{n-m=3}\end{array}\right.$,解之得m=8,n=11,所以X为O元素,Y为Na元素,根据元素对应的单质、化合物的结构和性质解答该题.
解答 解:元素X和元素Y在周期表中位于相邻的两个周期:X与Y两原子核外电子总数之和为19,则为短周期元素,且位于二、三周期,设X原子的质子数为m,Y原子的质子数为n,则有:$\left\{\begin{array}{l}{m+n=19}\\{n-m=3}\end{array}\right.$,解之得m=8,n=11,所以X为O元素,Y为Na元素,
A.O元素在自然界中可以游离态存在,空气中含有大量的氧气,故A错误;
B.O和Na可形成Na2O、Na2O2等化合物,故B错误;
C.氧元素形成的化合物种类比钠元素多,故C正确;
D.钠与盐溶液反应时首先与水反应生成氢氧化钠与氢气,在熔融状态下可置换出金属,故D错误.
故选C.
点评 本题考查元素的推断和元素化合物的性质,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意D选项熔融状态下钠与盐反应置换金属.

练习册系列答案
相关题目
8.可逆反应达到化学平衡状态的重要特征是( )
| A. | 反应停止了 | B. | 正、逆反应的速率都为0 | ||
| C. | 正、逆反应都还在进行 | D. | 正、逆反应的速率相等且不为0 |
9.常温下,向25mL 0.1mol•L-1弱碱MOH溶液中逐滴滴加0.2mol•L-1的HCl,溶液pH的变化曲线如图所示(溶液混合时体积的变化忽略不计).下列说法正确的是( )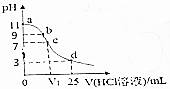

| A. | MOH电离方程式为:MOH═M++OH- | |
| B. | 在b点,离子浓度大小为c(OH-)>c(H+)>c(M+)>c(Cl-) | |
| C. | 在c点,滴加的V(HCl)>12.5mL | |
| D. | 在d点,c(Cl-)=2c(MOH)+2c(M+)=0.1mol•L-1 |
7.下列说法正确的是( )
| A. | 向稀的Na2CO3和NaHCO3溶液中加入CaCl2溶液均有白色沉淀产生 | |
| B. | 向Al2(SO4)3溶液中逐滴滴入NaOH溶液与向NaOH溶液中逐滴滴入Al2(SO4)3溶液,产生的现象相同 | |
| C. | 等质量的Al分别与过量的NaOH、HCl溶液反应,NaOH溶液中放出的H2多 | |
| D. | 分别向Na2CO3和NaHCO3溶液中滴加澄清石灰水,都能生成白色沉淀 |
11.下列关于硅的化学性质的叙述,正确的是( )
| A. | 常温时不和任何酸反应 | B. | 常温时可和强碱溶液反应 | ||
| C. | 单质硅比碳的还原性弱 | D. | 单质硅比碳的氧化性强 |
8.t℃时某Ba(OH)2稀溶液中,c(H+)=10-xmol•L-1、c(OH-)=10-ymol•L-1,且x+y=16.向该溶液中逐滴加入pH=m的盐酸,t℃下测得混合液的pH如下表所示(假设混合时体积变化忽略不计),则m、n分别为( )
| 序号 | Ba(OH)2溶液体积/mL | 盐酸体积/mL | 混合液pH |
| 1 | 22.00 | 0 | 10 |
| 2 | 22.00 | 22.00 | 8 |
| 3 | 22.00 | 18.00 | n |
| A. | 4、9 | B. | 4、7 | C. | 6、9 | D. | 6、7 |

 .
.
 .
. .
. .
.