��Ŀ����
��ˮ���̲��ŷḻ����Դ����ˮ�ۺ����õ�����ͼ��ͼ��
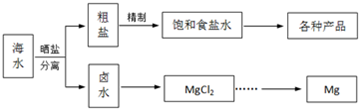
��1�������к�Ca2+��Mg2+��Fe3+��SO42-����ɳ�����ʣ���Ҫ�ᴿ������ۺ����ã�
�����ᴿ�IJ����У��ټ��������Na2CO3��Һ���ڼ��������BaCl2��Һ���ۼ��������NaOH��Һ���ܵ�����Һ��pH����7�����ܽ⣻���ˣ� ����������ȷ�IJ���˳���� ����д�����ĸ����
A���ݢ٢ۢڢܢޢ�B���ݢ٢ڢۢޢܢ�C���ݢۢ٢ڢޢܢ�D���ݢۢڢ٢ޢܢ�
��2��NaCl��ԭ�Ͽ��Եõ����ֲ�Ʒ��
�ٹ�ҵ���ɽ������Ʊ��������Ƶķ����ǣ���������Ѹ���������ۻ����������¶���300-400�棬ͨ�뾭�������Ŀ������Ƶù������ƣ����иô�����Ŀ���� ����ҵ���������¶ȹ��Ͷ��ò��������Ĺ������ƣ�����Ϊ���ܺ��е������� ���ѧʽ����
��ʵ�����ö��Ե缫���100mL0.1mol/LNaCl��Һ���������������õ�112mL���壨��״��������������Һ��pHΪ �����Է�Ӧǰ����Һ������仯����
�۵���Ȼ���ϡ��Һ���Ʊ���84����Һ����ͨ��ʱ��������Һ��ȫ���գ�����������Һ����һ�����ʣ�д����Ӧ�Ļ�ѧ����ʽ�� ��
��3����������κ��±ˮ���̺��ŷḻ��þ��Դ����ת����ɻ��MgCl2�ֲ�Ʒ��
�ٴֲ�Ʒ����Һ�к���Na+��Fe2+��Fe3+��Mn2+���轫Fe2+��Fe3+��Mn2+ת��Ϊ������ȥ�����������Һ�м���һ��������1���еõ�������NaClO��Ȼ�������Һ��pHΪ ��
���ڼ��õ���ˮ��������ڵ�������Ƕþ�������õ绯ѧԭ������ֹ�ڵ���ʴ��д�������ĵ缫��Ӧʽ�� ��

��1�������к�Ca2+��Mg2+��Fe3+��SO42-����ɳ�����ʣ���Ҫ�ᴿ������ۺ����ã�
�����ᴿ�IJ����У��ټ��������Na2CO3��Һ���ڼ��������BaCl2��Һ���ۼ��������NaOH��Һ���ܵ�����Һ��pH����7�����ܽ⣻���ˣ� ����������ȷ�IJ���˳����
A���ݢ٢ۢڢܢޢ�B���ݢ٢ڢۢޢܢ�C���ݢۢ٢ڢޢܢ�D���ݢۢڢ٢ޢܢ�
��2��NaCl��ԭ�Ͽ��Եõ����ֲ�Ʒ��
�ٹ�ҵ���ɽ������Ʊ��������Ƶķ����ǣ���������Ѹ���������ۻ����������¶���300-400�棬ͨ�뾭�������Ŀ������Ƶù������ƣ����иô�����Ŀ����
��ʵ�����ö��Ե缫���100mL0.1mol/LNaCl��Һ���������������õ�112mL���壨��״��������������Һ��pHΪ
�۵���Ȼ���ϡ��Һ���Ʊ���84����Һ����ͨ��ʱ��������Һ��ȫ���գ�����������Һ����һ�����ʣ�д����Ӧ�Ļ�ѧ����ʽ��
��3����������κ��±ˮ���̺��ŷḻ��þ��Դ����ת����ɻ��MgCl2�ֲ�Ʒ��
�ٴֲ�Ʒ����Һ�к���Na+��Fe2+��Fe3+��Mn2+���轫Fe2+��Fe3+��Mn2+ת��Ϊ������ȥ�����������Һ�м���һ��������1���еõ�������NaClO��Ȼ�������Һ��pHΪ
���ڼ��õ���ˮ��������ڵ�������Ƕþ�������õ绯ѧԭ������ֹ�ڵ���ʴ��д�������ĵ缫��Ӧʽ��
| ���� | ��ʼ���� | ������ȫ |
| Fe��OH��3 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Mn��OH��2 | 8.3 | 9.5 |
| Mg��OH��2 | 10.0 | 11.1 |
���㣺��ˮ��Դ�����ۺ�����,���ԭ��,���ʵķ��롢�ᴿ�Ļ�������ѡ����Ӧ��
ר�⣺ʵ�������
��������1��������ת��Ϊ�����������ȥ������������̼������ӣ���þ���������������ӣ���Fe3+�����������ӣ�������������ñ����ӣ�Ҫע������ʵ�˳��ӵ��Լ�����ܰ�ǰ���ȼӵĹ����Լ�������
��2���ٿ����еĶ�����̼��ˮ����������������Ʒ�Ӧ�����ȳ�ȥ�����еĶ�����̼��ˮ�������ƺ����������������������ƣ�
�ڸ��ݷ�Ӧ�����д����Ӧ�ĵ�ⷽ��ʽ�����ݷ���ʽ���м��㣻
���������֪����Ȼ�����Һ���ɴ������ƺ�������
��3���ٴ�ͼ�пɿ�����Fe2+��Fe3+��Mn2+ת��Ϊ������ȥ��PH���Ӧ��Ϊ9.5��PH=10ʱMg2+��ʼ������
�ڽ��������绯ѧ��ʴ������������ԭ��Ӧ��
��2���ٿ����еĶ�����̼��ˮ����������������Ʒ�Ӧ�����ȳ�ȥ�����еĶ�����̼��ˮ�������ƺ����������������������ƣ�
�ڸ��ݷ�Ӧ�����д����Ӧ�ĵ�ⷽ��ʽ�����ݷ���ʽ���м��㣻
���������֪����Ȼ�����Һ���ɴ������ƺ�������
��3���ٴ�ͼ�пɿ�����Fe2+��Fe3+��Mn2+ת��Ϊ������ȥ��PH���Ӧ��Ϊ9.5��PH=10ʱMg2+��ʼ������
�ڽ��������绯ѧ��ʴ������������ԭ��Ӧ��
���
�⣺��1��ȥ�����еĿ��������ʣ�Mg2+��Ca2+��Fe3+��SO42-ʱ�����Լ������NaOH��ȥ��þ���Ӻ������ӣ���Mg2++2OH-=Mg��OH��2����Fe3++3OH-�TFe��OH��3����
�������BaCl2��ȥ����������ӣ���SO42-+Ba2+=BaSO4�����������Na2CO3��ȥ�������ӵĶ���ı����ӣ���Ca2++CO32-=CaCO3��̼���Ʊ�������Ȼ���֮���������ƺ��Ȼ������Եߵ������˳��Ȼ�������Һ��pH����7���������ɣ�����˳��Ϊ�ݢۢڢ٢ޢܢ�ݢڢۢ٢ޢܢߣ�
�ʴ�Ϊ��D��
��2���ٿ����еĶ�����̼��ˮ����������������Ʒ�Ӧ�������ȳ�ȥ�����еĶ�����̼��ˮ��������ͨ�뵽�����кͽ����Ʒ�Ӧ�������¶Ƚϵ�ʱ���Ժ��������������������ƣ�
�ʴ�Ϊ����ֹ��������������еĶ�����̼��ˮ������Ӧ��Na2O��
�����ⱥ��ʳ��ˮ�ķ���ʽ��2NaCl+2H2O
2NaOH+H2��+Cl2������������H2�����Ϊ112mL��0.005molʱ�������������Ƶ����ʵ���Ϊ0.01mol��������Һ��NaOH�����ʵ���Ũ��=
�T0.1mol/L�����������ӵ�Ũ��Ϊ
=1��10-13mol/L��PH=13��
�ʴ�Ϊ��13��
�۸��������֪������������������Һ��Ӧ��������ֻ��һ�����ʣ����Ը�������ƫ�����ƣ���Ӧ�Ļ�ѧ����ʽ��NaCl+H2O
NaClO+H2����
�ʴ�Ϊ��NaCl+H2O
NaClO+H2����
��3���ٴ�ͼ�пɿ�����Fe2+��Fe3+��Mn2+ת��Ϊ������ȥ��PH���Ӧ��Ϊ9.5��PH=10.0ʱMg2+��ʼ����������PHֵ���ӦС��10.0��
�ʴ�Ϊ��9.5��PH��10.0��
�ڽ��������绯ѧ��ʴ������������ԭ��Ӧ���缫��ӦʽΪO2+4e-+2H2O�T4OH-��
�ʴ�Ϊ��O2+4e-+2H2O�T4OH-��
�������BaCl2��ȥ����������ӣ���SO42-+Ba2+=BaSO4�����������Na2CO3��ȥ�������ӵĶ���ı����ӣ���Ca2++CO32-=CaCO3��̼���Ʊ�������Ȼ���֮���������ƺ��Ȼ������Եߵ������˳��Ȼ�������Һ��pH����7���������ɣ�����˳��Ϊ�ݢۢڢ٢ޢܢ�ݢڢۢ٢ޢܢߣ�
�ʴ�Ϊ��D��
��2���ٿ����еĶ�����̼��ˮ����������������Ʒ�Ӧ�������ȳ�ȥ�����еĶ�����̼��ˮ��������ͨ�뵽�����кͽ����Ʒ�Ӧ�������¶Ƚϵ�ʱ���Ժ��������������������ƣ�
�ʴ�Ϊ����ֹ��������������еĶ�����̼��ˮ������Ӧ��Na2O��
�����ⱥ��ʳ��ˮ�ķ���ʽ��2NaCl+2H2O
| ||
| 0.01mol |
| 0.1L |
| 1��10-14 |
| 0.1 |
�ʴ�Ϊ��13��
�۸��������֪������������������Һ��Ӧ��������ֻ��һ�����ʣ����Ը�������ƫ�����ƣ���Ӧ�Ļ�ѧ����ʽ��NaCl+H2O
| ||
�ʴ�Ϊ��NaCl+H2O
| ||
��3���ٴ�ͼ�пɿ�����Fe2+��Fe3+��Mn2+ת��Ϊ������ȥ��PH���Ӧ��Ϊ9.5��PH=10.0ʱMg2+��ʼ����������PHֵ���ӦС��10.0��
�ʴ�Ϊ��9.5��PH��10.0��
�ڽ��������绯ѧ��ʴ������������ԭ��Ӧ���缫��ӦʽΪO2+4e-+2H2O�T4OH-��
�ʴ�Ϊ��O2+4e-+2H2O�T4OH-��
���������⿼���Ϊ�ۺϣ��漰���ʷ����ᴿ������֪ʶ����Ŀ�ۺ϶Ƚϸߣ��ѶȽϴ�ѧϰ��ע����ػ���֪ʶ�Ļ��ۣ�

��ϰ��ϵ�д�
�����Ŀ
��������Һ�еμ�Ba��OH��2��Һ����SO42-������ȫʱ����Ԫ�صĴ�����ʽ�ǣ�������
| A������Ϊ Al��OH��3������������Al3+��ʽ���� |
| B��ȫ����[Al��OH��4]-��AlO2-������ʽ���� |
| C��ȫ��ΪAl��OH��3���� |
| D������ΪAl��OH��3������Ϊ[Al��OH��4]- ��AlO2-�� |
�������зḻ��ʳƷ���������Դ��ҩ���ˮ����Դ�ȣ���ͼ��ʾ���������й�˵����ȷ���ǣ�������


| A���ڢٲ��г�ȥ�����е�SO42-��Ca2+��Mg2+��Fe3+�����ʣ�����ҩƷ��˳��ΪNa2CO3��NaOH��BaCl2������ |
| B���ڢڲ��нᾧ����MgCl2?6H2O���ڿ��������ȷֽ�����ˮMgCl2 |
| C���ڵڢۢܢݲ�����Ԫ�ؾ������� |
| D���ɺ�ˮ��ȡ�Ľ���þ���������������������Һ��һ���������γ�ԭ��أ�����þ����ԭ������� |
�����£�ȡ0.1 mol?L-1HY��Һ��0.1 mol?L-1NaOH��Һ�������ϣ����Ի�Ϻ���Һ����ı仯������û����Һ��pH=9��������˵������ȷ���ǣ�������
| A��c��Na+���Tc��Y-��+c��HY�� |
| B��c��OH-���Tc��H+��+c��HY�� |
| C��c��Y-����c��Na+����c��OH-����c��H+�� |
| D��c��Na+��+c��H+���Tc��OH-��+c��Y-�� |
�����ƶ���ȷ���ǣ�������
| A��NH3��HCl��ˮ��Һ���ܵ��磬��NH3���ǵ���� |
| B��Na2O��Na2O2���Ԫ����ͬ����CO2��Ӧ����Ҳ��ͬ |
| C��CO��NO��NO2���Ǵ�����Ⱦ���壬�ڿ����ж����ȶ����� |
| D��������ˮ��SO2������Ư���ԣ�����ʹ��ɫʯ����Һ��ɫ |
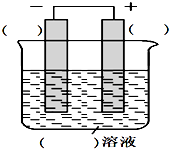 �����ǹ���ԭ��ص�ʵ�鷽�����밴Ҫ��ش��������⣺
�����ǹ���ԭ��ص�ʵ�鷽�����밴Ҫ��ش��������⣺