题目内容
向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是( )
| A、部分为 Al(OH)3沉淀,部分以Al3+形式存在 |
| B、全部以[Al(OH)4]-(AlO2-)的形式存在 |
| C、全部为Al(OH)3沉淀 |
| D、部分为Al(OH)3,部分为[Al(OH)4]- (AlO2-) |
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:设明矾KAl(SO4)2?12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应生成偏铝酸盐,铝元素的存在形式为:AlO2-.
解答:
解:设明矾KAl(SO4)2?12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;
铝元素的存在形式为:AlO2-.
故选B.
铝元素的存在形式为:AlO2-.
故选B.
点评:本题考查溶液中离子的共存,注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在标准状况下,由甲烷、甲醛和乙烷组成的11.2L混合气体完全燃烧后,生成15.68L相同状况下的CO2气体.则混合气体中乙烷的体积分数为( )
| A、20% | B、40% |
| C、60% | D、80% |
下列说法正确的是( )
| A、苯滴入溴水中振荡后水层接近无色,发生了化学反应 |
| B、乙烯和乙烷都可以与氢气发生加成反应 |
| C、烹鱼时加入少量食醋和料酒可以使烹制的鱼具有特殊的香味,这种香味来自于料酒中的乙醇和食醋中的乙酸反应生成的乙酸乙酯 |
| D、乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体 |
下列说法正确的是( )
| A、双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 |
| B、新制备的氯水中只存在三种分子、三种离子 |
| C、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| D、浓硝酸与浓盐酸一样,在空气中出现白雾 |
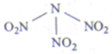 科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )
科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )| A、分子中四个氮原子共平面 |
| B、7.6 g N(NO2)3和N2O3混合物中共含氮原子数为0.2NA |
| C、标准状况下,2.24L N(NO2)3含有的分子数为0.1NA |
| D、15.2g该物质含有0.6NA个非极性键 |
CO2转化成有机物实现碳循环,是解决温室效应的有效途径之一,此反应化学平衡常数的表达式为:K=
且温度升高,K值变小.下列说法正确的是( )
| c(CH3OH).c(H2O) |
| c3(H2).c(CO2) |
| A、该反应的化学方程式为3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H>O |
| B、在恒温、恒容的密闭容器中,混合气体的密度不再改变时,该反应一定达到平衡状态 |
| C、在恒温、恒容的密闭容器中,增大H2的浓度时,CO2的转化率增大 |
| D、平衡时,其他条件不变,使用催化剂有利用于CO2的转化 |
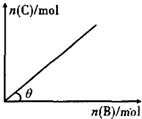 一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )
一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )| A、增加A的物质的量,正反应速率加快 |
| B、平衡时,其他条件不变,当温度升高时,θ变大 |
| C、图中曲线的斜率表示反应的化学平衡常数 |
| D、平衡时,其他条件不变,再通入B,则反应混合物的温度升高 |
下列说法不正确的是( )
| A、煤炭经气化,液化和干馏等过程,可获得清洁能源和重要的化工原料 |
| B、漂白粉和漂粉精不仅可以漂白棉,麻,纸张,还可做环境消毒剂 |
| C、Fe3O4俗称铁红,常做红色油漆和涂料 |
| D、蛋白质、淀粉、纤维素均属于天然有机高分子化合物 |