题目内容
16.用2mol/L的硝酸银溶液10mL,分别与相同体积的下列溶液恰好完全反应,则下列溶液中物质的量浓度最小的是( )| A. | BaCl2 | B. | MgCl2 | C. | KCl | D. | FeCl3 |
分析 消耗硝酸银的物质的量相等,则生成AgCl的物质的量相同,据氯离子守恒计算选项中各溶质的物质的量,根据相同体积时物质的量之比等于物质的量浓度之比来计算.
解答 解:参加反应的AgNO3的物质的量相同,则生成AgCl的物质的量相同,由银离子守恒可知n(AgCl)=n(AgNO3)=0.01mol×2mol/L=0.02mol,根据氯离子守恒可知:
n(BaCl2)=$\frac{1}{2}$n(AgCl)=$\frac{1}{2}$×0.002mol=0.001mol,
n(MgCl2)=$\frac{1}{2}$n(AgCl)=×0.002mol=0.01mol,
n(KCl)=n(AgCl)=0.02mol,
n(FeCl3)=$\frac{1}{3}$n(AgCl)=$\frac{1}{3}$×0.02mol=0.0067mol,
相同体积物质的量之比等于物质的量浓度之比,故KCl溶液的浓度最大,FeCl3浓度最小.
故选D.
点评 本题考查物质的量浓度的有关计算,比较基础,可以根据含有氯离子相等,不需要计算具体的值进行比较.

练习册系列答案
相关题目
6.肼(N2H4)又称联氨,可用如下方法制备:CO(NH2)2+ClO-+OH-=N2H4+Cl-+CO32-+H2O,下列说法不正确的是( )
| A. | N2H4是氧化产物 | B. | N2H4中存在极性键和非极性键 | ||
| C. | 配平后,OH-的化学计量数为2 | D. | 生成3.2gN2H4转移0.lmol电子 |
7.下列物质在水溶液中的电离方程式不正确的是( )
| A. | NaHSO4═Na++H++SO42- | B. | AgCl═Ag++Cl- | ||
| C. | Ba (OH)2═Ba2++2OH- | D. | CH3COONH4?NH4++CH3COO- |
4.关于二氧化硫的下列说法中,不正确的是( )
| A. | SO2是硫及其某些硫化物在空气中燃烧的产物 | |
| B. | SO2具有漂白作用,也有防腐作用 | |
| C. | SO2是硫酸的酸酐,称为硫酐 | |
| D. | SO2是一种大气污染物 |
1.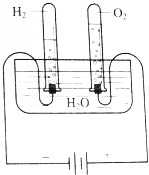 (1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成O2、H2的质量,根据O2、H2的摩尔质量,计算物质的量,并通过下表进行比较.
根据该实验的观察与推算能否初步得出下列结论:在相同温度和压强下.1molO2和H2的体积相同.
 (1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成O2、H2的质量,根据O2、H2的摩尔质量,计算物质的量,并通过下表进行比较.
| 质量g | 物质的量 | H2 和O2物质的量的比 | |
| H2 | |||
| O2 |
9.Y元素的阳离子和X元素的阴离子具有与氩原子相同的电子层结构,下列叙述不正确的是( )
| A. | Y的原子序数比X的大 | B. | Y的原子半径比X的大 | ||
| C. | Y原子的最外层电子数比X的大 | D. | Y元素的最高正价比X的大 |

 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2NaCl
+2NaCl 有多种同分异构体,其中含有苯环且苯环上只有两个取代基的同分异构体的数目为11(不含本身),其中核磁共振氢谱有3种峰的结构简式为
有多种同分异构体,其中含有苯环且苯环上只有两个取代基的同分异构体的数目为11(不含本身),其中核磁共振氢谱有3种峰的结构简式为


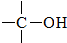 +
+ $→_{△}^{H_{2}SO_{4}(浓)}$
$→_{△}^{H_{2}SO_{4}(浓)}$ +H2O
+H2O +R′CHO$\stackrel{一定条件}{→}$
+R′CHO$\stackrel{一定条件}{→}$
 .
. .
. .
.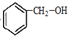 ,名称是苯甲醇.
,名称是苯甲醇. .
.