题目内容
5.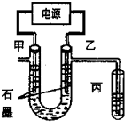 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:(1)甲电极的电极反应式为Cu2++2e-=Cu.
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为Cl2+2KI=2KCl+I2.
(3)随电解的不断进行,U型管中溶液的颜色变化为A;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是随电解进行,Cl-不断消耗,CuCl42-转化为Cu(H2O)42+.
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH) 2絮状物.经测,甲电极附近溶液的pH=a,此时甲电极附近c(Cu2+)=2.2×10(8-2a) mol•L-1.(已知:Cu(OH) 2的Ksp=2.2×10-20).
分析 (1)实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝,说明丙中生成碘,应被氯气氧化生成,则乙为阳极,生成氯气,甲为阴极,发生还原反应生成铜;
(2)丙中的KI-淀粉溶液慢慢变蓝,说明丙中生成碘,应是碘离子被氯气氧化生成;
(3)随着电解的进行,溶液中Cl-不断消耗,CuCl42-转化为Cu(H2O)42+,由Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O可知,溶液应逐渐变为蓝色;
(4)结合溶度积Ksp=c2(OH-)×c(Cu2+),计算溶液浓度.结合题给信息书写相关反应的离子方程式.
解答 解:实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝,说明丙中生成碘,应被氯气氧化生成,则乙为阳极,甲为阴极,
(1)甲为阴极,发生还原反应生成铜,电极方程式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)丙中溶液变蓝是乙电极产物氯气与KI反应导致的,反应的方程式为Cl2+2KI=2KCl+I2,
故答案为:Cl2+2KI=2KCl+I2;
(3)随着电解的进行,溶液中Cl-不断消耗,CuCl42-转化为Cu(H2O)42+,由Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O可知,溶液应逐渐变为蓝色,
故答案为:A;随电解进行,Cl-不断消耗,CuCl42-转化为Cu(H2O)42+;
(4)Ksp=c2(OH-)×c(Cu2+),c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{a-14})^{2}}$=2.2×10(8-2a)(mol/L)
故答案为:2.2×10(8-2a).
点评 本题考查综合考查电化学知识,侧重于电解的原理和考查与应用,为高考常见题型和高频考点,注意把握电极方程式的书写,难度不大.

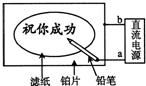 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生氧化反应 | B. | 铂片端作阴极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |

| A. | 电解结束后,阴极室溶液的pH与电解前相比将变大 | |
| B. | 若用铅蓄电池作该装置的供电电源,B接线柱应连接Pb | |
| C. | 涉及除去尿素的反应为CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl | |
| D. | 若通电一段时间后,电路中通过的电量是77.06×104C,则有8NA个H+通过质子交换膜 (一个电子所带的电量为1.6×10-19C) |
| A. | 提高臭氧浓度以改善空气质量 | B. | 提升矿物燃料的脱硫脱硝技术 | ||
| C. | 研发太阳能汽车代替燃油汽车 | D. | 开发不含氮、磷的洗涤清洁剂 |
| A. | 用纯碱溶液溶解苯酚:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 用强碱溶液吸收工业制取硝酸尾气:NO+NO2+2OH-═2NO3-+H2O | |
| C. | 用二氧化锰和浓盐酸反应制氯气:MNO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向AlCl3溶液中滴加过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |



 2NH3.
2NH3.