题目内容
9.核外电子数相等的原子一定是( )①同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤互为同位素.
| A. | ①②③ | B. | ①③⑤ | C. | ①②③④ | D. | 全部 |
分析 质子数=原子序数=核外电子数,质子数决定元素的种类;质量数=质子数+中子数;同位素是指同种元素形成的不同原子,据此解答.
解答 解:质子数=原子序数=核外电子数,质子数决定元素的种类;质量数=质子数+中子数;同位素是指同种元素形成的不同原子.
质子数决定元素的种类,质子数相同即核外电子数相同,元素种类相同,故①正确;
1H、2H的核外电子数相同,但不是同种原子,故②错误;
质子数=核外电子数,故③正确;
质量数=质子数+中子数,1H、2H的核外电子数相同都是1,但质量数不同,故④错误;
同位素是指同种元素形成的不同原子,既然是同种元素,那么质子数相同,核外电子数相同,故⑤正确;
故选B.
点评 本题考查原子结构,难度不大,明确质子数、中子数和质量数关系是解题的关键.

练习册系列答案
相关题目
19.等物质的量浓度的下列溶液中,c(H+)最大的是( )
| A. | NaHSO4 | B. | NaHCO3 | C. | NaH2PO4 | D. | CH3COOH |
20.现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
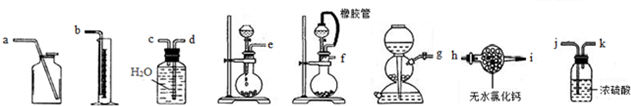
(1)第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.所选装置的连接顺序为(按气流方向,用接口字母表示):fcdb.若实验时称取的试样为 m g,产生的乙炔在标准状况下的体积为n mL,此试样中CaC2的质量分数为$\frac{64n}{22400m}$×100%.
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样6.80g、锥形瓶和水的质量为188.00g,再将试样加入锥形瓶中,用电子天平称量,实验装置如图所示.反应过程中每隔相同时间测得的数据如表:
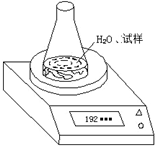
①不必作第六次读数的原因是第4、5次试验读数相同,表明锥形瓶内质量已达恒定反应进行完全.
②有同学认为用此装置测得的数据比真实值小,试分析原因:水蒸气随C2H2挥发.
③如何在原有装置上进行改进,使结果更加准确.请简要描述你的方案:在锥形瓶口添加一个带有无水氯化钙的干燥管的单孔橡皮塞.
(3)第三种方案:称取6.80g试样,用200mL 1.85mol/L的稀盐酸溶解,将所得的溶液转移至500mL容量瓶中,定容.取20mL定容后的溶液,用0.20mol/L的NaOH溶液滴定至终点,消耗NaOH溶液30.00mL,则6.80g试样中CaC2的质量为5.12g.

(1)第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.所选装置的连接顺序为(按气流方向,用接口字母表示):fcdb.若实验时称取的试样为 m g,产生的乙炔在标准状况下的体积为n mL,此试样中CaC2的质量分数为$\frac{64n}{22400m}$×100%.
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样6.80g、锥形瓶和水的质量为188.00g,再将试样加入锥形瓶中,用电子天平称量,实验装置如图所示.反应过程中每隔相同时间测得的数据如表:

| 锥形瓶+水+试样 | |||||
| 读数次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 质量/g | 192.80 | 192.30 | 192.10 | 192.00 | 192.00 |
②有同学认为用此装置测得的数据比真实值小,试分析原因:水蒸气随C2H2挥发.
③如何在原有装置上进行改进,使结果更加准确.请简要描述你的方案:在锥形瓶口添加一个带有无水氯化钙的干燥管的单孔橡皮塞.
(3)第三种方案:称取6.80g试样,用200mL 1.85mol/L的稀盐酸溶解,将所得的溶液转移至500mL容量瓶中,定容.取20mL定容后的溶液,用0.20mol/L的NaOH溶液滴定至终点,消耗NaOH溶液30.00mL,则6.80g试样中CaC2的质量为5.12g.
17.实验室有镁铝合金0.05mol,将其完全溶于100mL 1mol/L的H2SO4溶液中,再逐滴加入1mol/L氨水,当溶液中沉淀质量不再变化时,整个过程中至少需滴加氨水的体积为( )
| A. | 100mL | B. | 200mL | C. | 220mL | D. | 240mL |
4.下列物质的水溶液能导电,但该物质属于非电解质的是( )
| A. | CuSO4 | B. | CO2 | C. | HCl | D. | CH3CH2OH |
14.将X气体通入Y溶液中,实验结果与预测的现象一致的组合是( )
| 选项 | X气体 | Y溶液 | 预测的现象 |
| ① | CO2 | BaCl2溶液 | 白色沉淀析出 |
| ② | SO2 | Ba(N03)2溶液 | 白色沉淀析出 |
| ③ | Cl2 | AgNO3溶液 | 白色沉淀析出 |
| ④ | NH3 | FeCl2溶液 | 白色沉淀产生 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
18.下列说法正确的是( )
| A. | 每一周期元素都是从碱金属开始,以稀有气体结束 | |
| B. | f区都是副族元素,s区和p区的都是主族元素 | |
| C. | 铝的第一电离能小于K的第一电离能 | |
| D. | B电负性和Si相近 |
19.下列操作中正确的是( )
| A. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| B. | 浓硫酸沾在皮肤上时应用大量水冲洗,再涂上3%~5%的NaOH溶液 | |
| C. | 实验室进行蒸馏操作时若忘加了沸石,应停止反应冷却至室温后再加入 | |
| D. | 配制硫酸溶液时,可先在量筒中加一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |