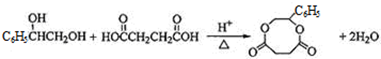题目内容
19.等物质的量浓度的下列溶液中,c(H+)最大的是( )| A. | NaHSO4 | B. | NaHCO3 | C. | NaH2PO4 | D. | CH3COOH |
分析 NaHSO4是强酸强碱酸式盐,在水溶液中完全电离;
NaHCO3、NaH2PO4都是强碱弱酸酸式盐,酸式酸根离子都能水解和电离,但其水解和电离程度都较小;
醋酸是弱电解质,在水溶液中部分电离.
解答 解:NaHSO4是强酸强碱酸式盐,在水溶液中完全电离;
NaHCO3、NaH2PO4都是强碱弱酸酸式盐,酸式酸根离子都能水解和电离,但其水解和电离程度都较小;
醋酸是弱电解质,在水溶液中部分电离,
假设这几种物质浓度都是1mol/L,
硫酸氢钠完全电离所以其溶液中c(H+)是1mol/L;
NaHCO3、NaH2PO4都是强碱弱酸酸式盐,酸式酸根离子都能水解和电离,这两种溶液中c(H+)都远远小于1mol/L,但磷酸二氢根离子电离程度大于碳酸氢根离子,所以c(H+)磷酸二氢钠大于碳酸氢钠;
醋酸是弱电解质,部分电离,其溶液中c(H+)小于1mol/L,但大于碳酸氢钠、磷酸二氢钠中c(H+),
所以这几种溶液中c(H+)大小顺序是A>D>C>B,故选A.
点评 本题以溶液pH计算为载体考查弱电解质的电离、盐类电离和水解等知识点,为高频考点,明确元素化合物性质是解本题关键,注意硫酸氢钠在水溶液中电离方式,该盐溶液中相当于强酸溶液,题目难度不大.

练习册系列答案
相关题目
20.向含有下列各组离子的溶液中滴加NaOH溶液,得到白色沉淀的是( )
| A. | Ba2+ HCO3- K+ Cl- | B. | CO32- OH- Na+ NO3- | ||
| C. | OH- Na+ SO42- CO32- | D. | Cu2+ Cl- Na+ NO3- |
14.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.110 | 0.113 | 0.102 | 0.075 | 0.071 |
| 主要化合价 | +5-3 | +3 | +6-2 | +5-3 | -2 |
| A. | 离子半径大小:r(M3+)>r(T2-) | B. | 氢化物稳定性:L<R | ||
| C. | X与T只能形成一种化合物 | D. | 含有M的化合物一定是离子化合物 |
4.下列溶液中:①石灰水 ②H2S溶液 ③KMnO4溶液④酸化的Ba(NO3)2溶液 ⑤溴水 ⑥品红溶液,不能区别SO2和CO2气体的是( )
| A. | 只有① | B. | ①③ | C. | ①②③⑤ | D. | ②③④⑤ |
11.短周期主族元素X、Y、Z、W的原子序数依次增大.X与W同主族,X、W的单质在标准状况下的状态不同.Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X),离子半径大小顺序:r(Z2-)>r(W+) | |
| B. | 元素Y的简单气态氢化物的热稳定性和熔沸点都比Z的高 | |
| C. | 由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 | |
| D. | 化合物X2Z2与W2Z2所含化学键类型完全相同 |
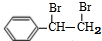
8.山梨酸是应用广泛的食品防腐剂,其结构如图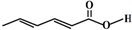 ,下列关于山梨酸的说法错误的是( )
,下列关于山梨酸的说法错误的是( )
 ,下列关于山梨酸的说法错误的是( )
,下列关于山梨酸的说法错误的是( )| A. | 分子式为C7H8O2 | |
| B. | 1mol该物质最多可与2mol Br2发生加成反应 | |
| C. | 可使酸性KMnO4溶液褪色 | |
| D. | 可与醇发生取代反应 |
9.核外电子数相等的原子一定是( )
①同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤互为同位素.
①同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤互为同位素.
| A. | ①②③ | B. | ①③⑤ | C. | ①②③④ | D. | 全部 |
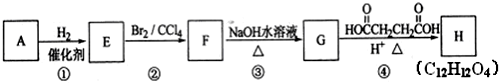
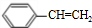 +Br2→
+Br2→