题目内容
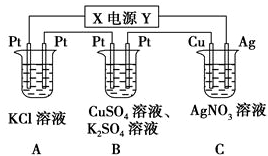
4.下列物质的水溶液能导电,但该物质属于非电解质的是( )| A. | CuSO4 | B. | CO2 | C. | HCl | D. | CH3CH2OH |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,溶液能导电说明含有自由移动的离子.
解答 解:A.在水溶液里,硫酸铜能电离出阴阳离子而使溶液导电,所以硫酸铜是电解质,故A错误;
B.二氧化碳和水反应生成碳酸,碳酸能电离出阴阳离子而使其溶液导电,所以二氧化碳是非电解质,故B正确;
C.氯化氢在水溶液里能电离出阴阳离子而使其溶液导电,所以氯化氢是电解质,故C错误;
D.CH3CH2OH不能电离,水溶液中不能导电,属于非电解质,故D错误;
故选B.
点评 本题考查了电解质和非电解质的判断,根据其定义来分析解答即可,题目难度不大.

练习册系列答案
相关题目
14.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.110 | 0.113 | 0.102 | 0.075 | 0.071 |
| 主要化合价 | +5-3 | +3 | +6-2 | +5-3 | -2 |
| A. | 离子半径大小:r(M3+)>r(T2-) | B. | 氢化物稳定性:L<R | ||
| C. | X与T只能形成一种化合物 | D. | 含有M的化合物一定是离子化合物 |
15.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是( )
| X | Y | |
| Z | W |
| A. | 原子半径:Z>X>Y | |
| B. | Y的最高正价与最低负价的和是4 | |
| C. | W的单质是工业制取盐酸的原料之一 | |
| D. | X、W的氢化物相遇会产生白烟 |
19.下列有关原子结构和元素周期律表述正确的是( )
| A. | 同周期中非金属性最强的元素位于本周期最右边 | |
| B. | 原子序数为15的元素的最高化合价为+3 | |
| C. | 原子序数为38的元素位于元素周期表的第五周期,第ⅡA族 | |
| D. | 第二周期,第ⅣA族元素的原子核电荷数和中子数一定为6 |
9.核外电子数相等的原子一定是( )
①同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤互为同位素.
①同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤互为同位素.
| A. | ①②③ | B. | ①③⑤ | C. | ①②③④ | D. | 全部 |
13.如图所示的原子结构示意图中,能组成AB2型化合物的是( )


| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
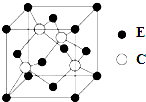 A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题: .
.