题目内容
17.实验室有镁铝合金0.05mol,将其完全溶于100mL 1mol/L的H2SO4溶液中,再逐滴加入1mol/L氨水,当溶液中沉淀质量不再变化时,整个过程中至少需滴加氨水的体积为( )| A. | 100mL | B. | 200mL | C. | 220mL | D. | 240mL |
分析 根据n=cV计算出100mL 1mol/L的H2SO4溶液中含有硫酸的物质的量,当溶液中沉淀质量不再变化时,此时溶质为硫酸铵,据此可知消耗一水合氨的物质的量,再根据V=$\frac{n}{c}$计算出滴加氨水的体积.
解答 解:100mL 1mol/L的H2SO4溶液中含有硫酸的物质的量为:1mol/L×0.1L=0.1mol,
镁铝合金与硫酸反应后生成铝离子、镁离子,硫酸可能剩余,再逐滴加入1mol/L氨水,当溶液中沉淀质量不再变化时,反应生成氢氧化铝、氢氧化镁沉淀,此时溶质为硫酸铵,
则该反应过程中消耗一水合氨的物质的量为0.1mol×2=0.2mol,
所以整个过程中至少需滴加氨水的体积为:$\frac{0.2mol}{1mol/L}$=0.2L=200mL,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
8.山梨酸是应用广泛的食品防腐剂,其结构如图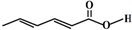 ,下列关于山梨酸的说法错误的是( )
,下列关于山梨酸的说法错误的是( )
 ,下列关于山梨酸的说法错误的是( )
,下列关于山梨酸的说法错误的是( )| A. | 分子式为C7H8O2 | |
| B. | 1mol该物质最多可与2mol Br2发生加成反应 | |
| C. | 可使酸性KMnO4溶液褪色 | |
| D. | 可与醇发生取代反应 |
2.下列关于卤代烃的叙述中正确的是( )
| A. | 所有卤代烃都含有卤原子 | |
| B. | 所有卤代烃都是通过取代反应制得的 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是难溶于水,密度比水小的液体 |
9.核外电子数相等的原子一定是( )
①同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤互为同位素.
①同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤互为同位素.
| A. | ①②③ | B. | ①③⑤ | C. | ①②③④ | D. | 全部 |
6.下列操作中,不正确的是( )
| A. | 苯酚沾在手上应立即用酒精洗涤 | |
| B. | 蒸馏、制乙烯时均需在反应器中加入少量碎瓷片 | |
| C. | 点燃甲烷、乙烯等可燃性气体前必须先检验其纯度 | |
| D. | 燃着的酒精灯打翻起火,应用水扑灭 |
7.某有机物R的结构简式如图所示.下列关于R的说法不正确的是( )
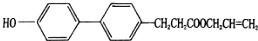

| A. | 能发生加成、加聚、水解和氧化反应 | |
| B. | 分子式为C18H20O3 | |
| C. | 该化合物最多有12个碳原子共平面 | |
| D. | 一定条件下1molR最多可以消耗2molNaoH |