题目内容
过碳酸钠(2Na2CO3?3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质.利用图2装置制备过碳酸钠,在冷水浴中充分反应后,按图1流程可获得过碳酸钠产品.
洗涤、干燥2Na2CO3 3H2O2固体滤液X反应液过滤图如图1

(1)恒压滴液漏斗中支管的作用是 .
(2)制备过碳酸钠的关键是 .
(3)如果配制过碳酸钠的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用.试分析其中的原因(写出其中一种即可,用方程式表示) .
(4)某化学学习小组为了定性探究铁离子对这种新型漂白剂的不良影响,取该漂白剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体.请选用下列试剂和实验用品完成气体成分的探究过程:0.1mol/L NaOH溶液、8.0mol/L NaOH溶液、澄清石灰水、0.01mol/L KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶.
①提出假设:对该气体成分提出合理假设.
假设1:气体是O2; 假设2:气体是 ; 假设3:气体是CO2.
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
洗涤、干燥2Na2CO3 3H2O2固体滤液X反应液过滤图如图1

(1)恒压滴液漏斗中支管的作用是
(2)制备过碳酸钠的关键是
(3)如果配制过碳酸钠的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用.试分析其中的原因(写出其中一种即可,用方程式表示)
(4)某化学学习小组为了定性探究铁离子对这种新型漂白剂的不良影响,取该漂白剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体.请选用下列试剂和实验用品完成气体成分的探究过程:0.1mol/L NaOH溶液、8.0mol/L NaOH溶液、澄清石灰水、0.01mol/L KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶.
①提出假设:对该气体成分提出合理假设.
假设1:气体是O2; 假设2:气体是
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有 | ① ② ③ |
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)恒压滴液漏斗中的支管主要作用是保持压强平衡利于液体流下;
(2)依据装置图分析可知制备过碳酸钠的关键是反应的温度控制;
(3)过碳酸钠具有Na2CO3和H2O2的双重性质,根据氯化铁对过碳酸钠的影响分析;
(4)①根据物质性质可知,生成的气体可能是氧气、二氧化碳,根据假设1分析,假设3为CO2,可知假设2是CO2和O2;
②根据二氧化碳和氧气的化学性质对气体进行检验:二氧化碳能使澄清石灰水变浑浊,氧气能使木条复燃.
(2)依据装置图分析可知制备过碳酸钠的关键是反应的温度控制;
(3)过碳酸钠具有Na2CO3和H2O2的双重性质,根据氯化铁对过碳酸钠的影响分析;
(4)①根据物质性质可知,生成的气体可能是氧气、二氧化碳,根据假设1分析,假设3为CO2,可知假设2是CO2和O2;
②根据二氧化碳和氧气的化学性质对气体进行检验:二氧化碳能使澄清石灰水变浑浊,氧气能使木条复燃.
解答:
解:(1)恒压滴液漏斗中的支管主要作用是保持压强平衡利于液体流下,故答案为:使液体顺利流下;
(2)利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品,所以关键是控制反应的温度,故答案为:控制反应温度;
(3)铁离子是过氧化氢分解的催化剂,能加速过氧化氢的分解,反应方程式为:2H2O2
H20+O2↑,铁离子和碳酸根离子发生双水解反应,反应方程式为:
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,都使过碳酸钠失效;
故答案为:2H2O2
H20+O2↑或2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
(4)①Na2CO3和H2O2混合(Na2CO3和H2O2不发生反应)可用作新型洗涤剂,加入氯化铁溶液反应生成的气体可能是氧气、二氧化碳或二者混合物,根据假设1分析,假设3为CO2,可知假设2是CO2和O2;
故答案为:CO2和O2;
②二氧化碳能使澄清石灰水变浑浊,氧气能使木条复燃是气体的特征性质,据此设计实验验证;
将气体通过澄清石灰水,氢氧化钠溶液,将带火星的木条放在最后一个洗气瓶的出气口,若澄清石灰水不变浑浊,木条复燃,证明含有氧气,假设1正确;若澄清石灰水变浑浊,木条复燃证明含有氧气和二氧化碳,假设2成立;若澄清石灰水变浑浊,木条不复燃证明含有二氧化碳,假设3正确,
故答案为;
.
(2)利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品,所以关键是控制反应的温度,故答案为:控制反应温度;
(3)铁离子是过氧化氢分解的催化剂,能加速过氧化氢的分解,反应方程式为:2H2O2
| ||
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,都使过碳酸钠失效;
故答案为:2H2O2
| ||
(4)①Na2CO3和H2O2混合(Na2CO3和H2O2不发生反应)可用作新型洗涤剂,加入氯化铁溶液反应生成的气体可能是氧气、二氧化碳或二者混合物,根据假设1分析,假设3为CO2,可知假设2是CO2和O2;
故答案为:CO2和O2;
②二氧化碳能使澄清石灰水变浑浊,氧气能使木条复燃是气体的特征性质,据此设计实验验证;
将气体通过澄清石灰水,氢氧化钠溶液,将带火星的木条放在最后一个洗气瓶的出气口,若澄清石灰水不变浑浊,木条复燃,证明含有氧气,假设1正确;若澄清石灰水变浑浊,木条复燃证明含有氧气和二氧化碳,假设2成立;若澄清石灰水变浑浊,木条不复燃证明含有二氧化碳,假设3正确,
故答案为;
| 实验操作 | 预期现象与结论 |
| 澄清石灰水;8.0mol?L-1NaOH溶液;并将带火星的木条放在最后一个洗气瓶的出口处. | ①若澄清石灰水不变浑浊,木条复燃,则假设1成立; ②若澄清石灰水变浑浊,木条复燃,则假设2成立; ③若澄清石灰水变浑浊,木条不复燃,则假设3成立. |
点评:本题考查了制备实验过程的分析判断,装置图的分析应用及气体的性质等方面的综合知识,注意“该晶体具有Na2CO3和H2O2的双重性质”是解题的关键信息,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用已被部分氧化的金属屑A制备某工业常用盐C的步骤如下:将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,下列判断正确的是( )
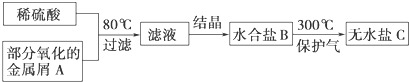

| A、过滤所得的残渣中一定没有金属A |
| B、滤液可能是CuSO4溶液或MgSO4溶液 |
| C、水合盐B可能是FeSO4?7H2O |
| D、无水盐C可能是Fe2(SO4)3 |
对蛋白质与氨基酸的下列看法,正确的是( )
| A、蛋白质都难溶于水,所以需在蛋白酶的作用下水解,方可被人体吸收 |
| B、有些易溶于水的蛋白质,被人体摄入后,不需水解成氨基酸,就可被人体吸收 |
| C、在浓硫酸钠溶液中,鸡蛋白能析出,在浓盐酸中,猪肝蛋白会发生变性 |
| D、天然蛋白质水解产物都是α氨基酸,都只含1个羧基和1个氨基 |
如图是制取气体的一种装置,能用此装置制取气体并能“随开随用,随关随停”的是( )
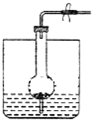

| A、二氧化锰与浓盐酸制Cl2 |
| B、过氧化钠与水制O2 |
| C、锌与稀硫酸制H2 |
| D、电石与水制取C2H2 |
两种金属组成的合金5.6g,与氯气完全反应,消耗氯气7.1g,则合金的组成可能( )
| A、Cu和Zn |
| B、Al和Zn |
| C、Al 和 Na |
| D、Cu和Fe |
下列说法正确的是( )
| A、增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| B、恒容容器中平衡体系A(g)?2B(g)中增加A的物质的量,A的转化率增大 |
| C、一定条件下反应2AB(g)?A2(g)+B2(g),当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态 |
| D、已知反应A2(g)+2B2(g)?2AB2(g)△H<0,升高温度,正向反应速率增加,逆向反应速率减小 |