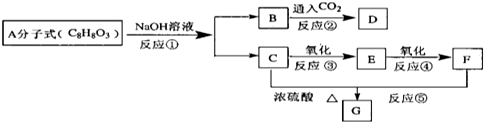
题目内容
用已被部分氧化的金属屑A制备某工业常用盐C的步骤如下:将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,下列判断正确的是( )
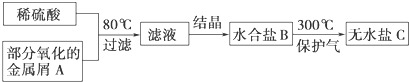

| A、过滤所得的残渣中一定没有金属A |
| B、滤液可能是CuSO4溶液或MgSO4溶液 |
| C、水合盐B可能是FeSO4?7H2O |
| D、无水盐C可能是Fe2(SO4)3 |
考点:铁盐和亚铁盐的相互转变,铁的氧化物和氢氧化物
专题:
分析:将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,该红褐色沉淀为氢氧化铁沉淀,说明C盐中含有亚铁离子,则A为部分氧化的铁屑,加硫酸有固体剩余,则固体为Fe,据此分析.
解答:
解:将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,该红褐色沉淀为氢氧化铁沉淀,说明C盐中含有亚铁离子,则水合盐B可能是FeSO4?7H2O;则A为部分氧化的铁屑,加硫酸有固体剩余,则固体为Fe,
故选C.
故选C.
点评:本题考查了铁的单质及化合物的性质,题目难度不大,注意根据氢氧化亚铁在空气中颜色变化来判断.

练习册系列答案
相关题目
某有机物的化学式为C5H10O,它能发生银镜反应.若将其跟H2加成所得产物的结构简式不可能是( )
| A、CH3(CH2)3CH2OH |
| B、CH3CH2CH(CH3)CH2OH |
| C、(CH3)2CHCH2CH2OH |
| D、(CH3CH2)2CHOH |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是(其他操作均正确)( )
| A、溶解后未冷却至室温就移入容量瓶 |
| B、向容量瓶加水时液面低于刻度线即摇匀 |
| C、称量时间过长 |
| D、向容量瓶加水定容时眼睛俯视刻度线 |
在碱性溶液中能大量共存且为无色透明溶液的是( )
| A、K+ Cl- MnO4- SO42- |
| B、Ca2+ CO32- NO3- SO42- |
| C、Na+ HCO3- NO3- SO42- |
| D、Na+ SO42- NO3- Cl- |
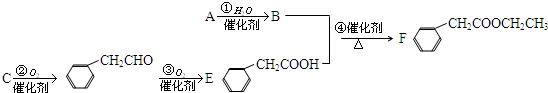
 的名称是
的名称是