题目内容
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、.0.1mol?L-1 pH=7.82的NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) |
| B、浓度均为0.1mol?L-1的NH3?H2O溶液和NH4Cl溶液等体积混合:[c(NH4+)+c(H+)]>[c(NH3?H2O)+c(OH-)] |
| C、0.1mol?L-1Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D、0.1mol?L-1Na2S溶液与0.1mol?L-1 NaHS溶液等体积混合:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.常温下pH=7.82的NH4HCO3溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可知c(HCO3-)<c(NH4+);
B.一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(Cl-)>c(NH3?H2O),根据电荷守恒判断;
C.根据硫化钠溶液中质子守恒进行判断,硫化氢中含有两个氢离子,其系数应该为2;
D.根据等浓度、等体积的硫化钠、硫氢化钠的混合液中的物料守恒进行判断.
B.一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(Cl-)>c(NH3?H2O),根据电荷守恒判断;
C.根据硫化钠溶液中质子守恒进行判断,硫化氢中含有两个氢离子,其系数应该为2;
D.根据等浓度、等体积的硫化钠、硫氢化钠的混合液中的物料守恒进行判断.
解答:
解:A.0.1mol?L-1pH=7.82的NH4HCO3溶液中,c(OH-)>c(H+),根据电荷守恒可得:c(HCO3-)+2c(CO32-)<c(NH4+),则c(HCO3-)<c(NH4+),溶液中离子浓度大小为:c(NH4+)>c(HCO3-)>c(OH-)>c(H+),故A错误;
B.浓度均为0.1mol?L-1的NH3?H2O溶液和NH4Cl溶液等体积混合,一水合氨的电离程度电离铵根离子的水解程度,则溶液中c(NH4+)>c(Cl-)>c(NH3?H2O);根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可得,:[c(NH4+)+c(H+)]>[c(NH3?H2O)+c(OH-)],故B正确;
C.0.1mol?L-1Na2S溶液中,水电离的氢离子和氢氧根离子浓度相等,即质子守恒,则:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;
D.0.1mol?L-1Na2S溶液与0.1mol?L-1 NaHS溶液等体积混合,根据物料守恒可得:2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S),整理可得:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S),故D正确;
故选BD.
B.浓度均为0.1mol?L-1的NH3?H2O溶液和NH4Cl溶液等体积混合,一水合氨的电离程度电离铵根离子的水解程度,则溶液中c(NH4+)>c(Cl-)>c(NH3?H2O);根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可得,:[c(NH4+)+c(H+)]>[c(NH3?H2O)+c(OH-)],故B正确;
C.0.1mol?L-1Na2S溶液中,水电离的氢离子和氢氧根离子浓度相等,即质子守恒,则:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;
D.0.1mol?L-1Na2S溶液与0.1mol?L-1 NaHS溶液等体积混合,根据物料守恒可得:2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S),整理可得:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S),故D正确;
故选BD.
点评:本题考查了溶液中离子浓度大小比较、盐的水解原理,题目难度中等,注意掌握电荷守恒、物料守恒、质子守恒的含义及使用方法,明确溶液中离子浓度大小比较常用方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、检验SO42-的试剂是HCl和BaCl2 |
| B、检验Cl-的试剂是AgNO3和HNO3 |
| C、向溶液中加入BaCl2后生成白色沉淀,即证明有SO42- |
| D、检验CO32-的试剂HCl,澄清的石灰水,和CaCl2 |
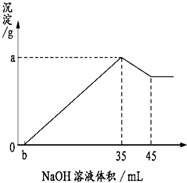 准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,
准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,求所用硫酸溶液的物质的量浓度( )
| A、1.75 mol/L |
| B、3.5 mol/L |
| C、2.25 mol/L |
| D、无法计算 |
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、1.0 mo1?L-1的Na2CO3溶液中:c(OH-)═c(HCO3-)+c(H+)+c(H2CO3) |
| B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3->c(CO32-)>c(H2CO3) |
| D、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) |
10mL 1mol?L-1盐酸与一小块大理石的化学反应:CaCO3+2HCl═CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
| A、加入一定量的CaCl2 |
| B、加入5 mL 1.5 mol?L-1盐酸 |
| C、加入15 mL 0.5 mol?L-1盐酸 |
| D、加入5 mL H2O |
根据右面的能量变化示意图,确定下列选项中正确的是( )


| A、2 A(g)+B(g)═2 C(g)△H<0 |
| B、2 A(g)+B(g)═2 C(g)△H>0 |
| C、2 C(g)═2A(g)+B(g) H>0 |
| D、2C(g)═2 A(g)+B(g) H<0 |
