题目内容
6.CO、H2、CH3OH均是清洁能源,一定条件下存在如下转化:CO(g)+2H2(g)?CH3OH(g)△H
(1)上述物质的有关化学键的键能(单位:kJ•mol-1)数据如下
C≡0:1076,H-H:436,C-H:408,C-O:351,O-H:463;
①上述生成CH3OH的反应的△H=-90kJ/mol.
②若2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,一定条件下,CH3OH(g)可进一步转化为CH30CH3(g)与H2O(g),试写出对应的热化学方程式:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol.
(2)分别向a、b、c三个容积相同的恒容密封容器中冲入10molCO与20molH2,在适当条件下发生反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中H2的浓度(mol•L-1)随时间(min)的变化如图中a、b、c曲线所示.
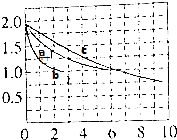
①b容器中的反应在3min时达到平衡,则b容器中v(CO)=$\frac{1}{6}$mol/(L.min).
②容器a、b中的反应条件的差异是b中使用催化剂,若a、c容器中的反应温度不同,则温度较低的容器是b(选填a或c).
③a容器中反应的平衡常数=1,三个容器中平衡常数相对大小关系为c>a=b.
为了寻找合成甲醇的适宜温度和压强,某科研小组设计了三组实验,部分实验数据如下表所示.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ① | 160 | $\frac{2}{3}$ | 1 |
| ② | x | $\frac{2}{3}$ | 5 |
| ③ | 260 | y | 5 |
分析 (1)①反应热=反应物总键能-生成物总键能;
②Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H
Ⅱ.2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,
由盖斯定律,Ⅱ-Ⅰ×2可得:2CH3OH(g)=CH3OCH3(g)+H2O(g);
(2)①根据v=$\frac{△c}{△t}$计算v(H2),再利用速率之比大于化学计量数之比计算v(CO);
②与a相比,b到达平衡时间短,且平衡时氢气浓度不变,平衡不移动,而正反应为气体物质的量减小的反应,压强影响平衡移动,则b使用催化剂;
温度越高,反应速率越快,到达平衡的时间越短;
③计算平衡时各组分的浓度,根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数;a的温度比c高,平衡时氢气浓度比c的大,说明升高温度平衡逆向移动,平衡常数减小,而a、b温度相同,二者平衡常数相同;
采取控制变量法分析,①与②压强不同,则温度、投料比相同;②与③温度不同,投料比相同.
解答 解:(1)①反应热=反应物总键能-生成物总键能,则:CO(g)+2H2(g)?CH3OH(g)的△H=1076kJ/mol+2×436kJ/mol-3×408kJ/mol-351kJ/mol-463kJ/mol=-90kJ/mol,
故答案为:-90kJ/mol;
②Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H=-90kJ/mol
Ⅱ.2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,
由盖斯定律,Ⅱ-Ⅰ×2可得:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol,
故答案为:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol;
(2)①v(H2)=$\frac{2mol-1mol/L}{3min}$=$\frac{1}{3}$mol/(L.min),速率之比大于化学计量数之比,则v(CO)=$\frac{1}{2}$v(H2)=$\frac{1}{6}$mol/(L.min),
故答案为:$\frac{1}{6}$mol/(L.min);
②与a相比,b到达平衡时间短,且平衡时氢气浓度不变,平衡不移动,而正反应为气体物质的量减小的反应,压强影响平衡移动,则b使用催化剂;
a与c相比,a达到平衡时间较短,温度越高,反应速率越快,到达平衡的时间越短,故温度a>c,
故答案为:b中使用催化剂;c;
③起始时氢气浓度为2mol/L,则CO的起始内为1mol/L,平衡时氢气浓度为1mol/L,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L):1 2 0
变化量(mol/L):0.5 1 0.5
平衡量(mol/L):0.5 1 0.5
故平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×{1}^{2}}$=1,
a的温度比c高,平衡时氢气浓度比c的大,说明升高温度平衡逆向移动,平衡常数减小,而a、b温度相同,二者平衡常数相同,故平衡常数c>a=b,
采取控制变量法分析,①与②压强不同,则温度、投料比相同,故x=160;②与③温度不同,投料比相同,则y=$\frac{2}{3}$,
故答案为:1;c>a=b;160;$\frac{2}{3}$.
点评 本题考查化学平衡有关计算、化学平衡图象、化学平衡常数、化学反应速率计算、反应热计算、热化学方程式书写等,侧重考查学生的分析计算能力,注意对基础知识的理解掌握.

 阅读快车系列答案
阅读快车系列答案| A. | 冰的密度小于液态水 | B. | 氨气易液化 | ||
| C. | HF的沸点高于HI | D. | 有机物普遍存在同分异构现象 |
| A. | 1mol ${\;}_{92}^{235}$U核素含有中子数为235NA | |
| B. | 1 L 0.l mol•L-1的醋酸溶液中含有H+数目为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 常温常压下,l.6gCH4中含有共价键总数为0.4 NA |
| A. | 标准状况下,2.24LSO3中硫原子数与1L0.1mol•L-1Na2SO3溶液中硫原子数相同 | |
| B. | 1mol•L-1FeCl3溶液全部制成胶体,其中含胶粒的数目小于NA | |
| C. | 1molNa2O2中含有NA个阴离子 | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
| A. | 该混合溶液中有:c(Na+)+c(H+)=c(HC2O4-)+c (OH-)+2 c (C2O42-) | |
| B. | 该混合溶液中有:c (Na+)=2 (c(HC2O4-)+c (H2C2O4)+c (C2O42-)) | |
| C. | 该混合溶液中有:c (OH-)-c(H+)=c(HC2O4-)+2 c (H2C2O4) | |
| D. | 该混合溶液中有:c (Na+)>c (C2O42-)>c(HC2O4-)>c (OH-)>c(H+) |
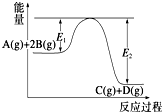
| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 升高温度,平衡常数K减小;压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |

