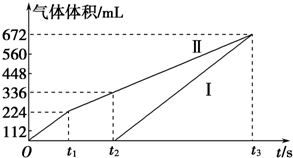
题目内容
16.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ 热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ•mol-1.分析 2gH2为1mol,完全燃烧生成0.5mol液态水,放出285.8kJ 热量.根据H2与放出热量列式.
解答 解:设其反应热的焓变为△H:
2H2(g)+O2(g)=2H2O(1)△H
2
1mol 285.8KJ
2:△H=1mol:285.8KJ
解得:△H=-571.6KJ/mol
故答案为:2H2(g)+O2(g)=2H2O(1)△H=-571.6KJ/mol
点评 题目给出的是氢气的质量,要换算成物质的量,结合与△H的关系.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
6.CO、H2、CH3OH均是清洁能源,一定条件下存在如下转化:
CO(g)+2H2(g)?CH3OH(g)△H
(1)上述物质的有关化学键的键能(单位:kJ•mol-1)数据如下
C≡0:1076,H-H:436,C-H:408,C-O:351,O-H:463;
①上述生成CH3OH的反应的△H=-90kJ/mol.
②若2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,一定条件下,CH3OH(g)可进一步转化为CH30CH3(g)与H2O(g),试写出对应的热化学方程式:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol.
(2)分别向a、b、c三个容积相同的恒容密封容器中冲入10molCO与20molH2,在适当条件下发生反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中H2的浓度(mol•L-1)随时间(min)的变化如图中a、b、c曲线所示.
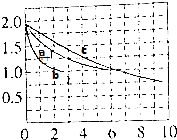
①b容器中的反应在3min时达到平衡,则b容器中v(CO)=$\frac{1}{6}$mol/(L.min).
②容器a、b中的反应条件的差异是b中使用催化剂,若a、c容器中的反应温度不同,则温度较低的容器是b(选填a或c).
③a容器中反应的平衡常数=1,三个容器中平衡常数相对大小关系为c>a=b.
为了寻找合成甲醇的适宜温度和压强,某科研小组设计了三组实验,部分实验数据如下表所示.
则x=160,y=$\frac{2}{3}$.
CO(g)+2H2(g)?CH3OH(g)△H
(1)上述物质的有关化学键的键能(单位:kJ•mol-1)数据如下
C≡0:1076,H-H:436,C-H:408,C-O:351,O-H:463;
①上述生成CH3OH的反应的△H=-90kJ/mol.
②若2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,一定条件下,CH3OH(g)可进一步转化为CH30CH3(g)与H2O(g),试写出对应的热化学方程式:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol.
(2)分别向a、b、c三个容积相同的恒容密封容器中冲入10molCO与20molH2,在适当条件下发生反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中H2的浓度(mol•L-1)随时间(min)的变化如图中a、b、c曲线所示.

①b容器中的反应在3min时达到平衡,则b容器中v(CO)=$\frac{1}{6}$mol/(L.min).
②容器a、b中的反应条件的差异是b中使用催化剂,若a、c容器中的反应温度不同,则温度较低的容器是b(选填a或c).
③a容器中反应的平衡常数=1,三个容器中平衡常数相对大小关系为c>a=b.
为了寻找合成甲醇的适宜温度和压强,某科研小组设计了三组实验,部分实验数据如下表所示.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ① | 160 | $\frac{2}{3}$ | 1 |
| ② | x | $\frac{2}{3}$ | 5 |
| ③ | 260 | y | 5 |
4.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1L1mol/L的氯化铁溶液中,若C1-的数目为3 NA,则Fe3+的数目为NA | |
| B. | 1 molN2和3 molH2在一定条件下充分反应,转移电子数目为6NA | |
| C. | 常温下,1L0.1mol/L的Na2S溶液中阴离子数目大于0.1 NA | |
| D. | 0.1 mol Cl2通入水中,转移电子的数目为0.1NA |
11.下列说法中用离子方程式表达正确的是( )
| A. | 用惰性电极电解氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Fe(NO3)2 溶液中滴加少量稀盐酸:Fe2++NO3-+4H+═Fe3++NO↑+2H2O |
1.高压下氮气聚合生成高聚氮,其晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构.已知晶体中N-N键的键能为160KJ/mol,而N≡N的键能为942KJ/mol.则下列说法不正确的是( )
| A. | 键能越大说明化学键越牢固,所构成的物质越稳定 | |
| B. | 高聚氮晶体属于原子晶体 | |
| C. | 该晶体中氮原子数与氮氮键数比为1:3 | |
| D. | 高聚氮可以用作炸药 |
8.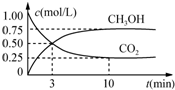 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3 min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 mol H2,平衡时CO2的转化率小于75% | |
| D. | 12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向逆反应方向进行 |
5.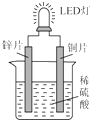 如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )
如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )
 如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )
如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )| A. | 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生 | |
| B. | 如果将锌片换成铁片,电路中的电流方向将改变 | |
| C. | 其能量转化的形式主要是“化学能→电能→光能” | |
| D. | 如果将稀硫酸换成柠檬汁,LED灯将不会发光 |