题目内容
18.回答有关氨气的问题.
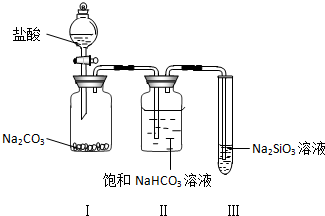
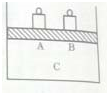
(1)实验室用装置A制取氨气的化学方程式是Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)用装置B也可制取氨气,简述反应原理CaO与水反应放热,促进氨气挥发;
(3)如图C、D、E三种收集氨气方法正确的是CD;
(4)甲、乙两同学用干燥的圆底烧瓶各收集一瓶氨气,并按如图F装置进行喷泉实验.简述能形成喷泉现象的实验原理:氨极易溶解于水,致使烧瓶内气体压强迅速减小.
分析 实验室可用氢氧化钙和氯化铵在加热条件下制备氨气,可用A装置,也可用浓氨水和氧化钙反应生成氨气,可用B装置,氨气密度比空气小,易溶于水,可用向下排空法收集,氨气为碱性气体,水溶液呈碱性,以此解答该题.
解答 解:(1)氨盐和碱反应生成氨气和水,实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,反应的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)CaO与水反应生成氢氧化钙,放热放出大量的热,可促使氨气挥发,进而生成氨气,故答案为:CaO与水反应放热,促进氨气挥发;
(3)氨气密度比空气小,易溶于水,可用向下排空法收集,不能用排饱和氯化铵溶液收集,故答案为:CD;
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,
故答案为:氨极易溶解于水,致使烧瓶内气体压强迅速减小.
点评 本题考查了氨气的性质和制取,为高频考点,侧重于学生的分析、实验嗯干了的考查,掌握铵盐和氨气的性质是解答的关键,题目难度不大.注意实验室制氨气的反应原理和形成喷泉的原理.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
4.有关金属晶体的说法不正确的是( )
| A. | 金属Cu的晶体的配位数为12 | |
| B. | 金属键是金属阳离子与自由电子间的相互作用 | |
| C. | 金属的延展性可以用电子气理论解释 | |
| D. | 金属Mg、Zn、Ti都是六方最密堆积,空间利用率是68% |
6.CO、H2、CH3OH均是清洁能源,一定条件下存在如下转化:
CO(g)+2H2(g)?CH3OH(g)△H
(1)上述物质的有关化学键的键能(单位:kJ•mol-1)数据如下
C≡0:1076,H-H:436,C-H:408,C-O:351,O-H:463;
①上述生成CH3OH的反应的△H=-90kJ/mol.
②若2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,一定条件下,CH3OH(g)可进一步转化为CH30CH3(g)与H2O(g),试写出对应的热化学方程式:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol.
(2)分别向a、b、c三个容积相同的恒容密封容器中冲入10molCO与20molH2,在适当条件下发生反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中H2的浓度(mol•L-1)随时间(min)的变化如图中a、b、c曲线所示.
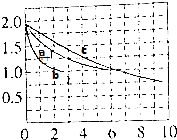
①b容器中的反应在3min时达到平衡,则b容器中v(CO)=$\frac{1}{6}$mol/(L.min).
②容器a、b中的反应条件的差异是b中使用催化剂,若a、c容器中的反应温度不同,则温度较低的容器是b(选填a或c).
③a容器中反应的平衡常数=1,三个容器中平衡常数相对大小关系为c>a=b.
为了寻找合成甲醇的适宜温度和压强,某科研小组设计了三组实验,部分实验数据如下表所示.
则x=160,y=$\frac{2}{3}$.
CO(g)+2H2(g)?CH3OH(g)△H
(1)上述物质的有关化学键的键能(单位:kJ•mol-1)数据如下
C≡0:1076,H-H:436,C-H:408,C-O:351,O-H:463;
①上述生成CH3OH的反应的△H=-90kJ/mol.
②若2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,一定条件下,CH3OH(g)可进一步转化为CH30CH3(g)与H2O(g),试写出对应的热化学方程式:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol.
(2)分别向a、b、c三个容积相同的恒容密封容器中冲入10molCO与20molH2,在适当条件下发生反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中H2的浓度(mol•L-1)随时间(min)的变化如图中a、b、c曲线所示.

①b容器中的反应在3min时达到平衡,则b容器中v(CO)=$\frac{1}{6}$mol/(L.min).
②容器a、b中的反应条件的差异是b中使用催化剂,若a、c容器中的反应温度不同,则温度较低的容器是b(选填a或c).
③a容器中反应的平衡常数=1,三个容器中平衡常数相对大小关系为c>a=b.
为了寻找合成甲醇的适宜温度和压强,某科研小组设计了三组实验,部分实验数据如下表所示.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ① | 160 | $\frac{2}{3}$ | 1 |
| ② | x | $\frac{2}{3}$ | 5 |
| ③ | 260 | y | 5 |
8.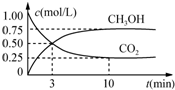 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3 min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 mol H2,平衡时CO2的转化率小于75% | |
| D. | 12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向逆反应方向进行 |
 有如下化学反应:2A(g)+B(g)?2C(g),△H<0.
有如下化学反应:2A(g)+B(g)?2C(g),△H<0.