题目内容
11.氨气在工农业生产中有重要应用,工业上用下列方法合成氨.回答下列问题: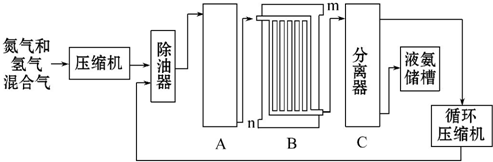
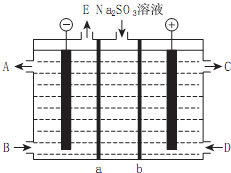
(1)合成氨的原料--N2来源于空气、H2来源于煤和天然气,用N2、H2在合成塔中合成NH3,为了提高N2的转化率,在理论上可采取的措施有增大H2的浓度、及时将NH3从混合气体中分离出来(写两条即可).
(2)设备B的名称是冷却塔(或冷凝器),设备C的作用是将液氨与未反应的原料气分离.
(3)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,某反应的化学方程式为NH3+HClO?H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因:加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用.
(4)化学家侯德榜改革国外的纯碱生产工艺,利用合成氨的产品NH3和副产品CO2先后通入饱和食盐水中而达到生产纯碱的目的.步骤如下:
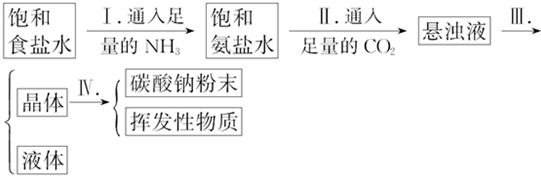
操作Ⅰ、Ⅱ不能颠倒的原因是若Ⅰ、Ⅱ颠倒,则得不到浓的NH4HCO3溶液,便不能析出NaHCO3晶体,Ⅲ的操作名称叫过滤.
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液.
(6)已知四种盐在不同温度下的溶解度(g/100g水)表(已知:35℃,NH4HCO3会分解)如下:
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
分析 (1)提高N2的转化率,从平衡正向移动分析;
(2)设备B的名称是冷却塔(或冷凝器);设备C的作用是将液氨与未反应的原料气分离;
(3)加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用;
(4)二氧化碳的溶解度较小,通入氨气使溶液呈碱性,增加了二氧化碳的溶解度,便于析出NaHCO3晶体;分离固体和液体的操作是过滤;
(5)检验是否含氯化钠用稀硝酸和硝酸银溶液;
(6)若高于35℃,则NH4HCO3分解,若低于30℃,则反应速率降低,采取的加热方法应为水浴加热.
解答 解:(1)从平衡移动原理上分析增大H2的浓度、及时将NH3从混合气体中分离出来或增大压强均可提高N2的转化率,
故答案为:增大H2的浓度;及时将NH3从混合气体中分离出来;
(2)设备B的名称是冷却塔(或冷凝器),设备C的作用是将液氨与未反应的原料气分离,
故答案为:冷却塔(或冷凝器);将液氨与未反应的原料气分离;
(3)对于可逆反应:NH3+HClO?H2O+NH2Cl,加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用,
故答案为:加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用;
(4)二氧化碳的溶解度较小,中性的氯化钠溶液不易吸收二氧化碳,通入氨气后,溶液呈碱性,增加了二氧化碳的溶解度,利用吸收二氧化碳气体,以便生成碳酸氢钠,若Ⅰ、Ⅱ颠倒,则得不到浓的NH4HCO3溶液,便不能析出NaHCO3晶体;分离固体和液体的操作是过滤,
故答案为:若Ⅰ、Ⅱ颠倒,则得不到浓的NH4HCO3溶液,便不能析出NaHCO3晶体;过滤;
(5)检验是否含氯化钠用稀硝酸和硝酸银溶液,产生不溶的白色沉淀,说明溶液在含氯化钠,
故答案为:稀硝酸和硝酸银溶液;
(6)若高于35℃,则NH4HCO3分解,若低于30℃,则反应速率降低,采取的加热方法应为水浴加热,
故答案为:NH4HCO3;反应速率降低;水浴加热.
点评 本题考查工业合成氨、侯氏制碱的方法,用化学平衡移动知识指导实际生产,学生要能学以致用,提高化学学科素养,增强综合素质,题目难度适中.

 阅读快车系列答案
阅读快车系列答案| A. | a+8+m-n | B. | a+18-m+n | C. | a+32-m-n | D. | a+24-m-n |
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
(2)N和O中,原子半径较小的是O;
(3)单质的化学性质最不活泼的是Ar;
(4)S原子结构示意图是
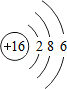 ;
;(5)HF和HCl中,热稳定性较强的是HF;
(6)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(7)元素最高价氧化物对应的水化物中,具有两性的是Al2O3(填化学式),碱性最强的是NaOH(填化学式);
(8)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(9)碳元素的最高价氧化物的化学式是CO2,其碳元素与氧元素的物质的量比n(C):n(O)=1:2.
| A. | CCl2F2 | B. |  | C. | CH3CH2OH | D. |  |
| A. | 液化石油气、汽油、柴油和润滑油的主要成分都是碳氢化合物 | |
| B. | 可以通过灼烧时的特殊气味来鉴别蛋白质 | |
| C. | 用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| D. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 |