题目内容
11.要除去CO2气体中混有的少量HCl、CO和水蒸气等杂质,用下列有关仪器组成除杂装置,若混合气体的流向从左到右,则仪器的连接顺序为(填写各接口的字母)混合气体→C;D;E;F;B.
分析 碳酸氢钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
氧化铜在加热条件下能和一氧化碳反应生成铜和二氧化碳;
浓硫酸具有吸水性,可以用来干燥二氧化碳、氢气、氧气等气体.
解答 解:把混合气体通入饱和碳酸氢钠溶液中,能够除去氯化氢气体,再把混合气体通入盛有氧化铜的装置中,能够除去一氧化碳气体,再把混合气体通入浓硫酸中,能够除去水蒸气,最后得到干燥的二氧化碳气体,则则仪器的连接顺序为:C→D→E→F→B.
故答案为:C;D;E;F;B.
点评 除去二氧化碳中的杂质气体过程中,二氧化碳气体不能减少,但是可以增加,例如除去氯化氢气体的过程中,二氧化碳气体增加,要注意理解.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
1.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
(1)写出上述实验中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)实验结果表明,催化剂的催化效果与催化剂的表面积有关.
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的表面积有关.
6.下列各组顺序的排列不正确的是( )
| A. | 离子半径:Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4 | |
| D. | 熔点:SiO2>NaCl>Na>CO2 |
20.有关钠与乙醇的说法中,错误的是( )
| A. | 钠的密度比乙醇的大 | |
| B. | 乙醇分子中6个氢原子的化学性质完全相同 | |
| C. | 钠与乙醇的反应比钠与水的反应缓和 | |
| D. | 钠与乙醇反应产生的气体可以燃烧,燃烧前必须验纯 |
11.氨气在工农业生产中有重要应用,工业上用下列方法合成氨.回答下列问题:
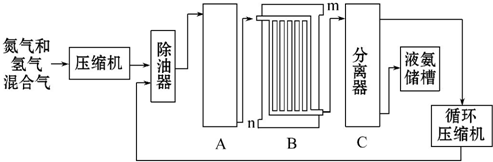
(1)合成氨的原料--N2来源于空气、H2来源于煤和天然气,用N2、H2在合成塔中合成NH3,为了提高N2的转化率,在理论上可采取的措施有增大H2的浓度、及时将NH3从混合气体中分离出来(写两条即可).
(2)设备B的名称是冷却塔(或冷凝器),设备C的作用是将液氨与未反应的原料气分离.
(3)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,某反应的化学方程式为NH3+HClO?H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因:加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用.
(4)化学家侯德榜改革国外的纯碱生产工艺,利用合成氨的产品NH3和副产品CO2先后通入饱和食盐水中而达到生产纯碱的目的.步骤如下:
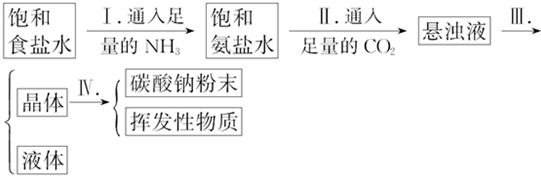
操作Ⅰ、Ⅱ不能颠倒的原因是若Ⅰ、Ⅱ颠倒,则得不到浓的NH4HCO3溶液,便不能析出NaHCO3晶体,Ⅲ的操作名称叫过滤.
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液.
(6)已知四种盐在不同温度下的溶解度(g/100g水)表(已知:35℃,NH4HCO3会分解)如下:
反应温度控制在30~35℃,是因为若高于35℃,则NH4HCO3,若低于30℃,则反应速率降低,为控制此温度范围,采取的加热方法为水浴加热.

(1)合成氨的原料--N2来源于空气、H2来源于煤和天然气,用N2、H2在合成塔中合成NH3,为了提高N2的转化率,在理论上可采取的措施有增大H2的浓度、及时将NH3从混合气体中分离出来(写两条即可).
(2)设备B的名称是冷却塔(或冷凝器),设备C的作用是将液氨与未反应的原料气分离.
(3)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,某反应的化学方程式为NH3+HClO?H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因:加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用.
(4)化学家侯德榜改革国外的纯碱生产工艺,利用合成氨的产品NH3和副产品CO2先后通入饱和食盐水中而达到生产纯碱的目的.步骤如下:

操作Ⅰ、Ⅱ不能颠倒的原因是若Ⅰ、Ⅱ颠倒,则得不到浓的NH4HCO3溶液,便不能析出NaHCO3晶体,Ⅲ的操作名称叫过滤.
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液.
(6)已知四种盐在不同温度下的溶解度(g/100g水)表(已知:35℃,NH4HCO3会分解)如下:
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |

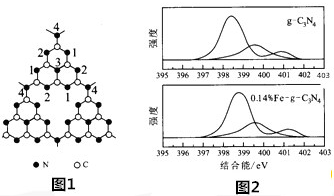 g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移. .
.