题目内容
20.硅单质及其化合物应用范围很广.请回答下列问题:(1)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
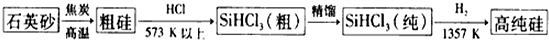
写出由纯SiHCl3,制备高纯硅的化学反应方程式SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
(2)下列关于硅单质及其化合物的说法正确的是AD
A.硅是构成一些岩石和矿物的基本元素
B.水泥、玻璃、水晶饰物都是硅酸盐制品
C.高纯度的硅单质广泛用于制作光导纤维
D.陶瓷是人类应用很早的硅酸盐材料
(3)硅酸钠水溶液俗称水玻璃,取少量硅酸钠溶液于试管中,逐滴加入盐酸溶液,振荡.试管中的实验现象为试管中有白色胶状沉淀生成,请写出化学方程式Na2SiO3+2HCl═H2SiO3↓+2NaCl.
分析 (1)SiHCl3与氢气反应生成硅和氯化氢;
(2)A.岩石和矿物的基本元素有硅元素;
B.水晶主要成分是二氧化硅,是氧化物;
C.光导纤维主要成分二氧化硅;
D.陶瓷的主要原料是黏土,则陶瓷是人类应用很早的硅酸盐材料.
(3)硅酸钠与盐酸反应生成硅酸和氯化钠,硅酸为白色胶状固体,据此解答.
解答 解:(1)SiHCl3与氢气反应生成硅和氯化氢,方程式:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
(2)A.岩石和矿物中含有硅酸盐、二氧化硅,所以岩石和矿物的基本元素有硅元素,故A正确;
B.水晶主要成分是二氧化硅,是氧化物,不是硅酸盐,故B错误;
C.二氧化硅广泛用于制作光导纤维,故C错误;
D.陶瓷的主要原料是黏土,则陶瓷是人类应用很早的硅酸盐材料,故D正确;
故选:AD;(3)硅酸钠与盐酸反应生成硅酸和氯化钠,方程式:Na2SiO 3+2HCl═H2 SiO 3↓+2NaCl,硅酸为白色胶状固体,所以会看到试管中有白色胶状沉淀生成;
故答案为:试管中有白色胶状沉淀生成;
Na2SiO 3+2HCl═H2 SiO 3↓+2NaCl;
点评 本题考查了硅及其化合物,涉及硅的制备与提纯,硅、二氧化硅的用途,明确相关物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
20.有关钠与乙醇的说法中,错误的是( )
| A. | 钠的密度比乙醇的大 | |
| B. | 乙醇分子中6个氢原子的化学性质完全相同 | |
| C. | 钠与乙醇的反应比钠与水的反应缓和 | |
| D. | 钠与乙醇反应产生的气体可以燃烧,燃烧前必须验纯 |
11.氨气在工农业生产中有重要应用,工业上用下列方法合成氨.回答下列问题:
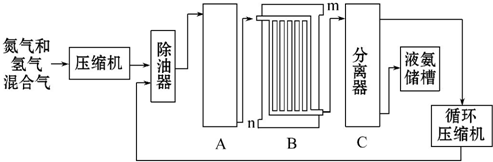
(1)合成氨的原料--N2来源于空气、H2来源于煤和天然气,用N2、H2在合成塔中合成NH3,为了提高N2的转化率,在理论上可采取的措施有增大H2的浓度、及时将NH3从混合气体中分离出来(写两条即可).
(2)设备B的名称是冷却塔(或冷凝器),设备C的作用是将液氨与未反应的原料气分离.
(3)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,某反应的化学方程式为NH3+HClO?H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因:加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用.
(4)化学家侯德榜改革国外的纯碱生产工艺,利用合成氨的产品NH3和副产品CO2先后通入饱和食盐水中而达到生产纯碱的目的.步骤如下:
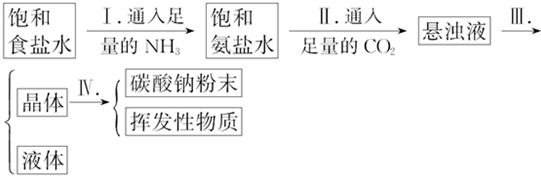
操作Ⅰ、Ⅱ不能颠倒的原因是若Ⅰ、Ⅱ颠倒,则得不到浓的NH4HCO3溶液,便不能析出NaHCO3晶体,Ⅲ的操作名称叫过滤.
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液.
(6)已知四种盐在不同温度下的溶解度(g/100g水)表(已知:35℃,NH4HCO3会分解)如下:
反应温度控制在30~35℃,是因为若高于35℃,则NH4HCO3,若低于30℃,则反应速率降低,为控制此温度范围,采取的加热方法为水浴加热.

(1)合成氨的原料--N2来源于空气、H2来源于煤和天然气,用N2、H2在合成塔中合成NH3,为了提高N2的转化率,在理论上可采取的措施有增大H2的浓度、及时将NH3从混合气体中分离出来(写两条即可).
(2)设备B的名称是冷却塔(或冷凝器),设备C的作用是将液氨与未反应的原料气分离.
(3)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,某反应的化学方程式为NH3+HClO?H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因:加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,上述化学平衡向左移动,又产生HClO,起杀菌作用.
(4)化学家侯德榜改革国外的纯碱生产工艺,利用合成氨的产品NH3和副产品CO2先后通入饱和食盐水中而达到生产纯碱的目的.步骤如下:

操作Ⅰ、Ⅱ不能颠倒的原因是若Ⅰ、Ⅱ颠倒,则得不到浓的NH4HCO3溶液,便不能析出NaHCO3晶体,Ⅲ的操作名称叫过滤.
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液.
(6)已知四种盐在不同温度下的溶解度(g/100g水)表(已知:35℃,NH4HCO3会分解)如下:
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
8.下列叙述中正确的是( )
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
15.下列热化学方程式表达正确的是( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | KOH(aq)+HNO3(aq)═KNO3+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1(反应热) |
5.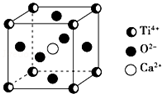 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为236 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
9.下列说法错误的是( )
| A. | 在共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电作用力形成的化学键,叫离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中不一定含有金属元素 |

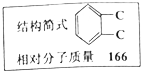 实验室有一试剂瓶的标签严重破损,只能隐约看到如图所示部分,取该试剂瓶中的试剂,通过燃烧实验测得:0.1mol该物质完全燃烧只得到39.6gCO2和9gH2O.
实验室有一试剂瓶的标签严重破损,只能隐约看到如图所示部分,取该试剂瓶中的试剂,通过燃烧实验测得:0.1mol该物质完全燃烧只得到39.6gCO2和9gH2O.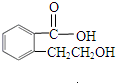 ;
; .
.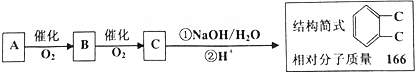
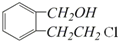 ;
;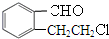 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2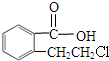 ;
; .
.