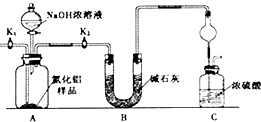
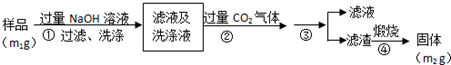
题目内容
12.下列有关说法正确的是( )| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化生成三氧化硫,不采用高压是因为压强对SO2转化率无影响 |
分析 A.反应自发进行的判断依据是△H-T△S<0;
B.依据溶液中离子积常数分析判断;
C.Cu的活泼性比Fe的弱,形成原电池,铁做负极;
D.压强对化学反应前后气体体积变化的反应的平衡移动有影响.
解答 解:A.化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发,所以焓变和熵变都不能独立地作为反应自发性的判据,故A错误;
B.同温、同浓度的盐酸和氢氧化钠稀溶液中,氢离子和氢氧根离子浓度相同,对水的电离抑制程度相同,水的电离程度相同,故B正确;
C.Cu的活泼性比Fe的弱,Cu作正极,不能保护Fe,所以为保护浸入海水中的钢闸门,一般在闸门表面镶上锌锭,故C错误;
D.二氧化硫的催化氧化不采用高压是考虑设备的耐压程度,压强对化学平衡会产生影响,增大压强,有利于二氧化硫的转化,故D错误;
故选:B.
点评 本题为综合题,涉及反应自发进行判断方法、水电离平衡影响因素、金属的腐蚀与防护,明确反应自发进行的判断依据是△H-T△S<0、熟悉化学平衡影响因素、原电池工作原理即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,17 g ND3中所含分子数目NA | |
| B. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA |
20.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.
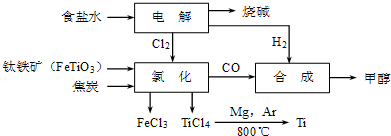
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第四周期,第ⅣB族;
(2)写出钛铁矿在高温下与焦炭、氯气反应得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO;
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•xH2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因由TiCl4+(2+x)H2O TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
(4)由TiCl4→Ti需要在Ar气中进行的理由是防止钛、镁被氧化;反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏(填分离方法)得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(5)由CO和H2合成甲醇的方程式是CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.

请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第四周期,第ⅣB族;
(2)写出钛铁矿在高温下与焦炭、氯气反应得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO;
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•xH2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因由TiCl4+(2+x)H2O
 TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;(4)由TiCl4→Ti需要在Ar气中进行的理由是防止钛、镁被氧化;反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏(填分离方法)得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
7.下列变化属于吸热反应的是 ( ) ①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解 ⑤生石灰跟水反应.
| A. | ②④ | B. | ①②④ | C. | ②③ | D. | ①④⑤ |
17.水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下0.1mol•L-1的NaOH溶液中,溶液的pH=11.
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为CO32-+H2O=HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出的c(OH-)=10-3 mol•L-1.
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
①25℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为Na2CO3>NaCN>CH3COONa(填化学式).
②25℃时,在0.5mol/L 的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的9×108倍.
(1)纯水在100℃时,pH=6,该温度下0.1mol•L-1的NaOH溶液中,溶液的pH=11.
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为CO32-+H2O=HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出的c(OH-)=10-3 mol•L-1.
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②25℃时,在0.5mol/L 的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的9×108倍.
4.四种短周期元素W、X、Y、Z在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
| W | X | |
| Y | Z |
| A. | X、Y、Z三种元素的最简单氢化物中最不稳定的是Y | |
| B. | W、Y、Z三种元素对应氧化物的水化物一定都是强酸 | |
| C. | W、X元素的最简单氢化物都是非电解质 | |
| D. | Z元素的单质在化学反应中只能表现氧化性 |
1.标准NaOH溶液滴定盐酸实验中,不必用到的是( )
| A. | 酚酞 | B. | 圆底烧瓶 | C. | 锥形瓶 | D. | 滴定管 |