题目内容
4.四种短周期元素W、X、Y、Z在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| W | X | |
| Y | Z |
| A. | X、Y、Z三种元素的最简单氢化物中最不稳定的是Y | |
| B. | W、Y、Z三种元素对应氧化物的水化物一定都是强酸 | |
| C. | W、X元素的最简单氢化物都是非电解质 | |
| D. | Z元素的单质在化学反应中只能表现氧化性 |
分析 W、X、Y、Z四种短周期元素,W的气态氢化物可与其最高价含氧酸生成离子化合物,为铵盐,可知W是N元素;由元素在周期表中的位置可知,X为氧元素、Y为硫元素、Z为氯元素,以此来解答.
解答 解:W、X、Y、Z四种短周期元素,W的气态氢化物可与其最高价含氧酸生成离子化合物,为铵盐,W是N元素;由元素在周期表中的位置可知,X为氧元素、Y为硫元素、Z为氯元素,
A.非金属O>S,Cl>S,则其氢化物中H2S最不稳定,故A正确;
B.HClO、亚硫酸等为弱酸,故B错误;
C.氨气本身不能电离,为非电解质,故C错误;
D.Cl2与水的反应中既表现氧化性,也表现了还原性,故D错误;
故选A.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
12.下列有关说法正确的是( )
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化生成三氧化硫,不采用高压是因为压强对SO2转化率无影响 |
9.(1)燃料电池是一种高效、环境友好的发电装置.氢氧燃料电池已用于航天飞机.以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为2H2+4OH--4e-═4H2O,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将减小(填“增大”“减小”或“不变”).
(2)居民使用的管道煤气主要成分是H2、CO和少量CH4、H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如下表:
天然气已经成为城市居民使用的主要生活能源.使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大空气(填“空气”或“天然气”)的进入量或减少天然气(填“空气”或“天然气”)的进入量.1m3(标准状况)甲烷在25℃,101kPa时,充分燃烧生成二氧化碳气体和液态水时释放的热能是3.97×104kJ.
(2)居民使用的管道煤气主要成分是H2、CO和少量CH4、H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如下表:
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
16.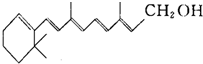 维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )
维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )
 维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )
维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )| A. | 维生素A的分子式为C20H28O | |
| B. | 维生素A是一种易溶于水的醇 | |
| C. | 维生素A能与酸发生酯化反应 | |
| D. | 1 mol维生素A在催化剂作用下最多可与7 mol H2发生加成反应 |
13.钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4.某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
(1)把一定量烤蓝铁片加工成均匀粉末.
(2)取m g该粉末,放入28.00mL 1mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4mL,向溶液中滴入KSCN溶液,无明显现象.
(3)再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
完成下列各题:
(1)实验(2)所得溶液中的溶质是FeCl2(写化学式).
(2)样品中n(Fe):n(Fe3O4)=4:1,m=0.912g.
(3)计算实验(3)中每份硝酸溶液的体积(V)(mL).
(4)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2+、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围.
(1)把一定量烤蓝铁片加工成均匀粉末.
(2)取m g该粉末,放入28.00mL 1mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4mL,向溶液中滴入KSCN溶液,无明显现象.
(3)再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
(1)实验(2)所得溶液中的溶质是FeCl2(写化学式).
(2)样品中n(Fe):n(Fe3O4)=4:1,m=0.912g.
(3)计算实验(3)中每份硝酸溶液的体积(V)(mL).
(4)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2+、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围.
14.某同学在实验室探究NaHCO3的性质:常温下,配制0.10mol/LNaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出.下列说法不正确的是( )
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的水解 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)═c(HCO3-)+2c(CO32-)+c(Cl-) |

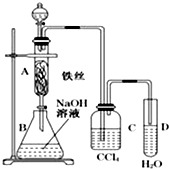 某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.