题目内容
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温常压下,17 g ND3中所含分子数目NA | |
| B. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA |
分析 A、ND3的摩尔质量为20g/mol;
B、溶液体积不明确;
C、用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则说明电解时阳极上生成的是0.1mol氧气,阴极上生成的是0.1mol铜和0.1mol氢气,据此分析;
D、二氧化硅是原子晶体.
解答 解:A、ND3的摩尔质量为20g/mol,故17gND3的物质的量小于1mol,则分子数小于NA个,故A错误;
B、溶液体积不明确,故溶液中水电离出的氢离子的个数无法计算,故B错误;
C、用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则说明电解时阳极上生成的是0.1mol氧气,阴极上生成的是0.1mol铜和0.1mol氢气,由于阳极上氧元素的价态由-2价变为0价,故当生成0.1mol氧气时转移0.4mol电子即0.4NA个,故C正确;
D、二氧化硅是原子晶体,故存在二氧化硅分子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13. 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | 水电离程度d<a<b<c | |
| B. | b点溶液的导电性比c点溶液的导电性弱 | |
| C. | a点KW的数值比c点KW的数值大 | |
| D. | b点酸的总浓度大于a点酸的总浓度 |
11.下列离子方程式书写正确的是( )
| A. | 向Na2S溶液中加入少量的氯化银:S2-+2Ag+═Ag2S↓ | |
| B. | 向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失:SiO${\;}_{3}^{2-}$+2H+═H2SiO3(胶体) | |
| C. | 碳酸氢铵溶液中加入足量NaOH:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 向苯酚钠溶液中通入一定量CO2: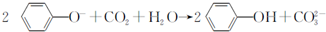 |
18.进行化学实验必须注意安全,下列说法不正确的是( )
| A. | 点燃氢气前要检验纯度,以免发生爆炸 | |
| B. | 不慎将浓盐酸沾到皮肤上,要立即用浓碱溶液冲洗 | |
| C. | CO气体有毒,处理CO尾气的方法一般是将其点燃,转化成无毒的CO2 | |
| D. | 在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子 |
12.下列有关说法正确的是( )
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化生成三氧化硫,不采用高压是因为压强对SO2转化率无影响 |
13.钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4.某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
(1)把一定量烤蓝铁片加工成均匀粉末.
(2)取m g该粉末,放入28.00mL 1mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4mL,向溶液中滴入KSCN溶液,无明显现象.
(3)再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
完成下列各题:
(1)实验(2)所得溶液中的溶质是FeCl2(写化学式).
(2)样品中n(Fe):n(Fe3O4)=4:1,m=0.912g.
(3)计算实验(3)中每份硝酸溶液的体积(V)(mL).
(4)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2+、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围.
(1)把一定量烤蓝铁片加工成均匀粉末.
(2)取m g该粉末,放入28.00mL 1mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4mL,向溶液中滴入KSCN溶液,无明显现象.
(3)再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
(1)实验(2)所得溶液中的溶质是FeCl2(写化学式).
(2)样品中n(Fe):n(Fe3O4)=4:1,m=0.912g.
(3)计算实验(3)中每份硝酸溶液的体积(V)(mL).
(4)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2+、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围.

 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.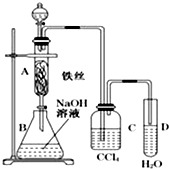 某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.