题目内容
下列说法中不正确的是( )
| A、乙烯与苯都能使溴水褪色,但褪色原理不同 |
| B、1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol |
| C、溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 |
D、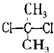 与 与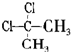 互为同分异构体 互为同分异构体 |
考点:乙烯的化学性质,同分异构现象和同分异构体,苯的性质,乙醛的化学性质
专题:同系物和同分异构体,有机反应
分析:A.乙烯与溴发生加成反应,使溴水中水层褪色;苯萃取溴水的溴,使溴水中水层褪色;
B.1mol乙烯与Cl2完全加成,消耗氯气1mol,生成1mol1,2-二氯乙烷,1mol1,2-二氯乙烷与4molCl2发生取代反应,生成1mol六氯乙烷;
C.溴水具有氧化性,醛基具有还原性;
D.甲烷是正四面体结构.
B.1mol乙烯与Cl2完全加成,消耗氯气1mol,生成1mol1,2-二氯乙烷,1mol1,2-二氯乙烷与4molCl2发生取代反应,生成1mol六氯乙烷;
C.溴水具有氧化性,醛基具有还原性;
D.甲烷是正四面体结构.
解答:
解:A.乙烯与溴发生加成反应,使溴水中水层褪色,溴在苯的溶解度远远大于水中的溶解度,苯萃取溴水的溴,使溴水中水层褪色,二者褪色原理不同,故A正确;
B.1mol乙烯与Cl2完全加成,消耗氯气1mol,生成1mol1,2-二氯乙烷,1mol1,2-二氯乙烷与4molCl2发生取代反应,生成1mol六氯乙烷,故共消耗氯气5mol,故B正确;
C.溴水具有氧化性,醛基具有还原性,溴水能与乙醛发生氧化还原反应,使溴水褪色,故C正确;
D.甲烷是正四面体结构,故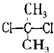 与
与 为同一物质,故D错误,
为同一物质,故D错误,
故选D.
B.1mol乙烯与Cl2完全加成,消耗氯气1mol,生成1mol1,2-二氯乙烷,1mol1,2-二氯乙烷与4molCl2发生取代反应,生成1mol六氯乙烷,故共消耗氯气5mol,故B正确;
C.溴水具有氧化性,醛基具有还原性,溴水能与乙醛发生氧化还原反应,使溴水褪色,故C正确;
D.甲烷是正四面体结构,故
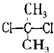 与
与 为同一物质,故D错误,
为同一物质,故D错误,故选D.
点评:本题考查乙烯、苯、醛基的性质以及甲烷的结构,难度不大,注意甲烷是正四面体结构.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
下列说法中不正确的是( )
| A、煤、石油、天然气均为化石能源 |
| B、化石能源是可再生能源 |
| C、直接燃烧煤不如将煤进行深加工后再燃烧效果好 |
| D、化石燃料在燃烧过程中能产生污染环境的SO2等有害气体 |
 25℃时,在20mL 0.1mol/L NaOH溶液中加入0.2mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
25℃时,在20mL 0.1mol/L NaOH溶液中加入0.2mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如图所示,若B点的横坐标a=10,下列分析的结论正确的是( )| A、在B点有:c(Na+)=c(CH3COO-) |
| B、对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
| D、D点时,c(CH3COO-)+c(CH3COOH)=c(Na+) |
已知H2A为弱酸,下列说法错误的是( )
| A、0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
| B、常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5 |
| C、常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性 |
| D、常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9 |
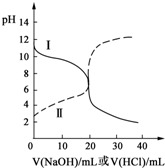 25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A、根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3?H2O)≈10-5 |
| B、当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交 |
| C、曲线Ⅱ:滴加溶液到10.00 mL时,溶液中c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
| D、在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小 |
下列叙述正确的是( )
| A、Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B、100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性 |
| C、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| D、在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
比较下列各组微粒半径,正确的是( )
①Cl<Cl-<Br-②F-<Mg2+<Al3+③Na+<Na<K ④S2-<Cl-<Br-.
①Cl<Cl-<Br-②F-<Mg2+<Al3+③Na+<Na<K ④S2-<Cl-<Br-.
| A、①和③ | B、只有② |
| C、只有③ | D、①和④ |
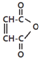 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).