题目内容
马来酐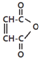 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).
(a)①1,4-加成 ②水解 ③氧化
(b)①1,4-加成 ②+H2O ③水解 ④氧化 ⑤消去并酸化
(c)①1,4-加成 ②+HCl ③水解 ④氧化 ⑤消去并酸化
(d)①1,4-加成 ②水解 ③+HCl ④氧化 ⑤消去并酸化
(1)以上路径设计中最合理的是 (选择填空).
(2)工业上可由乙炔或乙醛等为原料制取1,3-丁二烯.若实验室改由2-丁烯为原料制取少量1,3-丁二稀,首先考虑的比较合适的反应是 .(选择填充)
a.加HBr b.加H2O c.加Br2 d.取代反应.
 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).(a)①1,4-加成 ②水解 ③氧化
(b)①1,4-加成 ②+H2O ③水解 ④氧化 ⑤消去并酸化
(c)①1,4-加成 ②+HCl ③水解 ④氧化 ⑤消去并酸化
(d)①1,4-加成 ②水解 ③+HCl ④氧化 ⑤消去并酸化
(1)以上路径设计中最合理的是
(2)工业上可由乙炔或乙醛等为原料制取1,3-丁二烯.若实验室改由2-丁烯为原料制取少量1,3-丁二稀,首先考虑的比较合适的反应是
a.加HBr b.加H2O c.加Br2 d.取代反应.
考点:有机物分子中的官能团及其结构
专题:有机物的化学性质及推断
分析:(1)采用逆合成法根据HOOCCH=CHCOOH→1,3-丁二烯的转化设计合成方案,注意氧化前必须先通过加成反应保护碳碳双键;
(2)2-丁烯为原料制取少量1,3-丁二稀,应该先有2-丁烯得到CH3CH(X)CH(X)CH3,然后结构消去反应生成CH2=CHCH=CH2,据此进行解答.
(2)2-丁烯为原料制取少量1,3-丁二稀,应该先有2-丁烯得到CH3CH(X)CH(X)CH3,然后结构消去反应生成CH2=CHCH=CH2,据此进行解答.
解答:
解:(1)(a)①1,4-加成和②水解后生成HOCH2CH=CHCH2OH,③氧化时碳碳双键同时被氧化,无法得到目标产物,故(a)错误;
(b)①1,4-加成、②H2O水解得到含有3个羟基的醇,再经过④氧化后,所有羟基都被氧化,无法得到目标产物,故(b)错误;
(c)经过①1,4-加成、②+HCl和③水解生成含有三个羟基的醇,再经过④氧化后所有羟基都被氧化,无法进行⑤消去反应,无法得到目标产物,故(c)错误;
(d)经过①1,4-加成和②水解后生成HOCH2CH=CHCH2OH,再经过③+HCl将碳碳双键保护起来,经过④氧化得到HOOCCH2CH(Cl)COOH,最后⑤消去并酸化可以得到丁烯二酸(HOOCCH=CHCOOH),故(d)正确;
故答案为:d;
(2)根据逆合成法,制取CH2=CHCH=CH2应该先制取CH3CH(X)CH(X)CH3,制取CH3CH(X)CH(X)CH3应该让2-丁烯与卤素单质与2-丁烯发生加成反应,所以应该加入溴单质,即c正确,
故答案为:c.
(b)①1,4-加成、②H2O水解得到含有3个羟基的醇,再经过④氧化后,所有羟基都被氧化,无法得到目标产物,故(b)错误;
(c)经过①1,4-加成、②+HCl和③水解生成含有三个羟基的醇,再经过④氧化后所有羟基都被氧化,无法进行⑤消去反应,无法得到目标产物,故(c)错误;
(d)经过①1,4-加成和②水解后生成HOCH2CH=CHCH2OH,再经过③+HCl将碳碳双键保护起来,经过④氧化得到HOOCCH2CH(Cl)COOH,最后⑤消去并酸化可以得到丁烯二酸(HOOCCH=CHCOOH),故(d)正确;
故答案为:d;
(2)根据逆合成法,制取CH2=CHCH=CH2应该先制取CH3CH(X)CH(X)CH3,制取CH3CH(X)CH(X)CH3应该让2-丁烯与卤素单质与2-丁烯发生加成反应,所以应该加入溴单质,即c正确,
故答案为:c.
点评:本题考查了有机物的合成方案的设计,题目难度中等,明确有机物的结构与性质是解答本题关键,注意掌握根据逆合成法合成有机物的方法.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、乙烯与苯都能使溴水褪色,但褪色原理不同 |
| B、1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol |
| C、溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 |
D、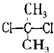 与 与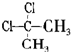 互为同分异构体 互为同分异构体 |
在25℃时两种酸的电离常数如下:H2CO3:Ki1=4.2×10-7,Ki2=5.6×10-11;H2S:Ki1=5.7×10-8,Ki2=1.2×10-15,则下列反应可能发生的是( )
| A、NaHCO3+NaHS→Na2CO3+H2S↑ |
| B、H2S+Na2CO3→NaHS+NaHCO3 |
| C、Na2S+H2O+CO2→Na2CO3+H2S↑ |
| D、H2S+NaHCO3→NaHS+H2CO3 |
 而不是
而不是 ,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是
,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是 某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题: