题目内容
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质.某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):
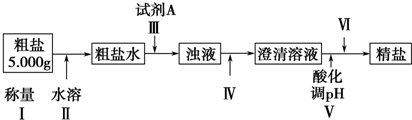
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):
A.烧杯 B.试管 C.玻璃棒 D.分液漏斗 E.漏斗 F.酒精灯 G.蒸发皿
(2)操作Ⅲ中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂,则加入除杂试剂的顺序为:NaOH溶液→ → .
(3)操作Ⅲ中,判断加入BaCl2已过量的方法是
(4)操作Ⅴ应选择的酸是 ,若将操作Ⅴ与操作Ⅳ的先后顺序对调,将会对实验结果产生的影响是 .
(5)操作Ⅵ是 (选择合理操作的名称,用标号字母按操作先后顺序填写).
a.过滤、洗涤 b.蒸发、浓缩 c.萃取、分液 d.冷却、结晶.

请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):
A.烧杯 B.试管 C.玻璃棒 D.分液漏斗 E.漏斗 F.酒精灯 G.蒸发皿
(2)操作Ⅲ中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂,则加入除杂试剂的顺序为:NaOH溶液→
(3)操作Ⅲ中,判断加入BaCl2已过量的方法是
(4)操作Ⅴ应选择的酸是
(5)操作Ⅵ是
a.过滤、洗涤 b.蒸发、浓缩 c.萃取、分液 d.冷却、结晶.
考点:粗盐提纯
专题:实验题
分析:(1)操作Ⅳ实现了浊液中不溶性固体与液体的分离,为过滤操作;
(2)过量碳酸钠溶液可以除掉Ca2+、过量的Ba2+;
(3)利用SO42-和Ba2+反应生成白色沉淀,取所得溶液的上层清液于试管中,再滴入少量BaCl2溶液,观察是否浑浊判断;
(4)为了除掉新的杂质离子OH-、CO32-,本着少引入新的杂质的原则选择酸,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应;
(5)由氯化钠溶液得到纯净氯化钠晶体的操作是:蒸发、浓缩-冷却、结晶-过滤、洗涤.
(2)过量碳酸钠溶液可以除掉Ca2+、过量的Ba2+;
(3)利用SO42-和Ba2+反应生成白色沉淀,取所得溶液的上层清液于试管中,再滴入少量BaCl2溶液,观察是否浑浊判断;
(4)为了除掉新的杂质离子OH-、CO32-,本着少引入新的杂质的原则选择酸,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应;
(5)由氯化钠溶液得到纯净氯化钠晶体的操作是:蒸发、浓缩-冷却、结晶-过滤、洗涤.
解答:
解:(1)浊液通过操作Ⅳ得到了澄清溶液,实现了浊液中不溶性固体与液体的分离,为过滤操作,用到的仪器有:烧杯、玻璃棒、漏斗,
故答案为:ACE;
(2)过量碳酸钠溶液可以除掉Ca2+、过量的Ba2+,因此Na2CO3溶液必须在BaCl2溶液之后加入,
故答案为:BaCl2溶液;Na2CO3溶液;
(3)利用SO42-和Ba2+反应生成白色沉淀,取所得溶液的上层清液于试管中,再滴入少量BaCl2溶液,观察是否浑浊判断,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取所得溶液的上层清液于试管中,再滴入少量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(4)为了除掉新的杂质离子OH-、CO32-,本着少引入新的杂质的原则选择盐酸,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,使溶液中产生杂质离子,从而影响精盐的纯度,
故答案为:盐酸;在酸性条件下,会有部分沉淀溶解,从而影响精盐的纯度;
(5)由氯化钠溶液得到纯净氯化钠晶体的操作是:蒸发、浓缩-冷却、结晶-过滤、洗涤,洗涤的目的是除去氯化钠晶体吸附的离子,
故答案为:bda.
故答案为:ACE;
(2)过量碳酸钠溶液可以除掉Ca2+、过量的Ba2+,因此Na2CO3溶液必须在BaCl2溶液之后加入,
故答案为:BaCl2溶液;Na2CO3溶液;
(3)利用SO42-和Ba2+反应生成白色沉淀,取所得溶液的上层清液于试管中,再滴入少量BaCl2溶液,观察是否浑浊判断,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取所得溶液的上层清液于试管中,再滴入少量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(4)为了除掉新的杂质离子OH-、CO32-,本着少引入新的杂质的原则选择盐酸,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,使溶液中产生杂质离子,从而影响精盐的纯度,
故答案为:盐酸;在酸性条件下,会有部分沉淀溶解,从而影响精盐的纯度;
(5)由氯化钠溶液得到纯净氯化钠晶体的操作是:蒸发、浓缩-冷却、结晶-过滤、洗涤,洗涤的目的是除去氯化钠晶体吸附的离子,
故答案为:bda.
点评:本题考查较为综合,涉及物质分离提纯、除杂以及离子检验等知识,为高频考点,把握除杂不能引入新的杂质及试剂的添加顺序为解答的关键,注意除杂试剂过量,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子.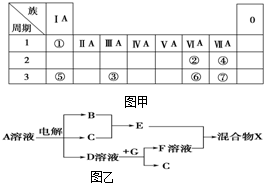 如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题: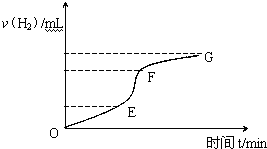 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答: