题目内容
8.冰晶石是一种矿物,主要成分为六氟合铝酸钠(Na3AlF6),微溶于水,熔融的冰晶石能溶解氧化铝,在电解铝工业作助熔剂,制造乳白色玻璃和搪瓷的遮光剂.工业上生产Na3AlF6的主要流程如下:
试结合生产流程回答下列问题:
(1)浸取后的“残渣”中一定含有的成分是CaSiO3,硫酸铝与NaF(aq)反应的离子方程式为3Na++6F-+Al3+=Na3AlF6↓;
(2)为提高NaF的浸出率,煅烧后的固体在浸取前应采取的措施为粉碎,为得到纯净的Na3AlF6产品,操作a包括的主要操作步骤为过滤→洗涤→干燥;
(3)在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF(aq)的pH下调至5左右,请解释其原因是F-、Al3+发生双水解而生成氢氧化铝沉淀;
(4)78kg含CaF280%的氟石(杂质不含氟元素)理论上可生产Na3AlF656kg(设生产过程中的每一步含氟物质均完全转化);
(5)碳酸化法也是工业制取Na3AlF6的一种方法:在偏铝酸钠及氟化钠溶液中,通入足量二氧化碳即可,请写出该反应的化学方程式6NaF+4CO2+NaAlO2+2H2O=Na3AlF6↓+4NaHCO3_.
分析 工业上生产Na3AlF6的主要流程:氟化钙、石英、纯碱高温煅烧:CaF2+Na2CO3 +SiO2$\frac{\underline{\;高温\;}}{\;}$ CO2↑+2NaF+CaSiO3↓,加水浸取,残渣为CaSiO3,加入硫酸铝,
硫酸铝与NaF(aq)反应的离子方程式为:3Na++6F-+Al3+=Na3AlF6↓,过滤、洗涤、干燥得纯净的Na3AlF6产品.
(1)根据CaF2+Na2CO3 +SiO2$\frac{\underline{\;高温\;}}{\;}$ CO2↑+2NaF+CaSiO3↓,可知浸取后的“残渣”中一定含有的成分是CaSiO3,硫酸铝与NaF(aq)反应生成Na3AlF6;
(2)煅烧后的固体在浸取前进行粉碎能提高NaF的浸出率,硫酸铝与NaF(aq)反应生成Na3AlF6沉淀,需先过滤后洗涤干燥得到纯净的Na3AlF6产品;
(3)硫酸铝为强酸弱碱盐,氟化钠为强碱弱酸盐,两者能发生双水解反应生成氢氧化铝沉淀;
(4)根据氟元素守恒进行解答,3CaF2~Na3AlF6;
(5)在偏铝酸钠及氟化钠溶液中,通入足量二氧化碳生成六氟铝酸钠沉淀和碳酸氢钠.
解答 解:(1)氟化钙、石英、纯碱高温煅烧:CaF2+Na2CO3 +SiO2$\frac{\underline{\;高温\;}}{\;}$ CO2↑+2NaF+CaSiO3↓,加水浸取,氟化钠溶于水,硅酸钙难溶于水,所以残渣一定为硅酸钙,硫酸铝与NaF(aq)反应生成Na3AlF6沉淀,离子反应为:3Na++6F-+Al3+=Na3AlF6↓,
故答案为:CaSiO3;3Na++6F-+Al3+=Na3AlF6↓;
(2)将块状固体进行粉碎能增大接触面积,煅烧后的固体在浸取前进行粉碎,浸取时能提高NaF的浸出率,硫酸铝与NaF(aq)反应生成Na3AlF6沉淀,分离固体、液体用过滤进行分离,沉淀表面有杂质需进行洗涤,然后进行干燥得到纯净的Na3AlF6产品,
故答案为:粉碎;过滤、洗涤、干燥;
(3)硫酸铝为强酸弱碱盐,氟化钠为强碱弱酸盐,两者能发生双水解反应,离子反应为:3F-+Al3++3H2O=3HF↑+Al(OH)3↓,为防止双水解发生,所以加入硫酸铝溶液前,需先用硫酸将NaF(aq)的pH下调至5左右,
故答案为:F-、Al3+发生双水解而生成氢氧化铝沉淀;
(4)78kg含CaF280%的氟石n(CaF2)=$\frac{78kg×80%}{78g/mol}$=8×102mol,生产过程中的每一步含氟物质均完全转化,根据氟元素守恒:3CaF2~Na3AlF6,n(Na3AlF6)=8×102mol×$\frac{1}{3}$,m(Na3AlF6)=nM=8×102mol×$\frac{1}{3}$×210g/mol=56kg,
故答案为:56kg;
(5)根据题干信息:碳酸化法也是工业制取Na3AlF6的一种方法,在偏铝酸钠及氟化钠溶液中,通入足量二氧化碳必生成六氟铝酸钠沉淀,根据原子守恒,反应为:6NaF+4CO2+NaAlO2+2H2O=Na3AlF6↓+4NaHCO3,
故答案为:6NaF+4CO2+NaAlO2+2H2O=Na3AlF6↓+4NaHCO3.
点评 本题考查了Na3AlF6的制备,涉及物质的分离与提纯、离子反应方程式的书写、化学计算,理解原理以及熟练综合应用元素化合物知识是解答关键,题目难度中等.

 作业辅导系列答案
作业辅导系列答案| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 ? NaOH H2O |
| A. | 12C和14C | B. | H2O和D2O | C. | O2和O3 | D. | 淀粉和纤维素 |
a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2.用稍过量硝酸溶解碳酸钙样品.
步骤3.用石灰水调整溶液pH=5.
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩(蒸发结晶)、趁热过滤、洗涤干燥得甲酸钙晶体.


已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
Ⅰ.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a
(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K b.1350~1360K
Ⅱ.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
2NaCl(s)+H2SO4(浓) QUOTE 2HCl↑+Na2SO4
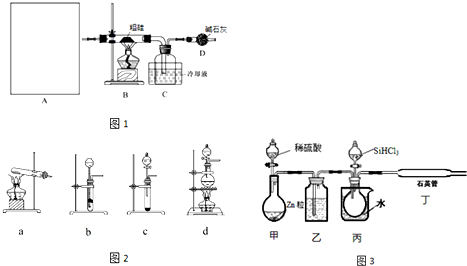
A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是(如图2)bd(填装置序号字母);
a.冷凝管 b.圆底烧瓶 c.蒸馏烧瓶 d.分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如图3:
①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
a.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
b.向装置中添加药品;
c.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
d.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.
| A. | B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强 | |
| B. | 发生氧化还原反应时,A原子失去的电子比B原子多,证明A的金属性一定比B强 | |
| C. | 适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI3 | |
| D. | 一定量氯气通入30 mL 10.00 mol•L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25 |
