题目内容
20.晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.
已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
Ⅰ.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a
(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K b.1350~1360K
Ⅱ.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
2NaCl(s)+H2SO4(浓) QUOTE 2HCl↑+Na2SO4
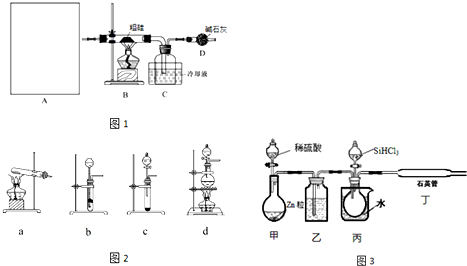
A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是(如图2)bd(填装置序号字母);
a.冷凝管 b.圆底烧瓶 c.蒸馏烧瓶 d.分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如图3:
①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
a.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
b.向装置中添加药品;
c.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
d.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.
分析 Ⅰ.根据反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0可知,该反应为放热反应,根据温度对平衡移动的影响答题;
II.(1)根据题中制HCl的实验原理,为固体和液体加热,据此选择装置,反应中有剩余的氯化氢气体未反应,要吸收,同时SiHCl3易水解,要防止空气中的水分进入装置;
(2)液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,根据这些物质的沸点不同,可选择分馏的方法进行除杂,根据分馏操作的装置可选择仪器;
(3)用SiHCl3与H2反应制备纯硅,组装好仪器后,要先进行气密性检验,再在装置中通氢气,排尽空气后再进行SiHCl3与H2的反应,实验结束时还要继续通氢气,直到装置冷却,防止空气中的成分对反应干扰,根据装置可知,丙处是水浴,丁处进行SiHCl3与H2的反应,都要进行加热,实验尾气中有氯化氢等气体不能直接排到空气中,据此答题.
解答 解:Ⅰ.根据反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0可知,该反应为放热反应,升高温度,平衡移动会逆向移动,不利于SiHCl3的生成,所以选择温度较低的条件,即选a,
故答案为:a;因反应 Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
II.(1)根据题中制HCl的实验原理,为固体和液体加热,所以选择d装置,反应中有剩余的氯化氢气体未反应,要吸收,同时SiHCl3易水解,要防止空气中的水分进入装置,所以D中装碱石灰用来吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解,
故答案为:d;吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,根据这些物质的沸点不同,可选择分馏的方法进行除杂,所以流程中操作①为分馏,根据分馏操作的装置可知,不是分馏操作所需的仪器是b d,
故答案为:分馏;b d;
(3)①用SiHCl3与H2反应制备纯硅,组装好仪器后,要先进行气密性检验,再在装置中通氢气,排尽空气后再进行SiHCl3与H2的反应,实验结束时还要继续通氢气,直到装置冷却,防止空气中的成分对反应干扰,所以实验步骤的顺序为dbacef,根据装置可知,丙处是水浴,丁处进行SiHCl3与H2的反应,都要进行加热,所以步骤c中需要加热的装置为丙、丁,
故答案为:dbacef;丙、丁;
②实验尾气中有氯化氢等气体不能直接排到空气中,而根据装置可知,装置中无尾气处理装置,
故答案为:无尾气处理装置.
点评 本题考查制备实验方案的设计,综合了氯气的制法、硅的提纯、物质的分离提纯、对装置与操作的分析评价等实验知识,结合物质的性质明确原理为解答的关键,题目难度中等.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案| A. | 酸性高锰酸钾和草酸的反应中,加硫酸锰可大大加快反应速率 | |
| B. | 硫代硫酸钠和硫酸的反应中有硫和二氧化硫产生 | |
| C. | 同一反应,不同催化剂的催化效果不一样 | |
| D. | H2O2的分解的方程式:H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ H2↑+O2↑ |
| A. | c(H+)•c(OH-) | B. | c(OH-) | ||
| C. | $\frac{c({H}^{+}•c(C{H}_{3}CO{O}^{-}))}{c(C{H}_{3}COOH)}$ | D. | $\frac{c(C{H}^{+})}{c(C{H}_{3}COOH)}$ |



 据报道,苹果醋是由苹果发酵而成的酸性饮品,其中的酸性物质主要是苹果酸.有关苹果酸的结构确定及合成过程如下:
据报道,苹果醋是由苹果发酵而成的酸性饮品,其中的酸性物质主要是苹果酸.有关苹果酸的结构确定及合成过程如下: .
.

 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O.
+(2n-1)H2O. 、
、 .
.