题目内容
1.下列四种元素中,单质的氧化性最强的是( )| A. | 原子最外层电子数为次外层电子数的2倍 | |
| B. | 第三周期ШA族元素 | |
| C. | 原子核外L层电子数为K层电子数的3倍 | |
| D. | 第16号元素 |
分析 A.原子最外层电子数为次外层电子数的2倍,为C元素;
B.第三周期ШA族元素为Al;
C.原子核外L层电子数为K层电子数的3倍,则为O元素;
D.第16号元素为S.
解答 解:A.原子最外层电子数为次外层电子数的2倍,为C元素;
B.第三周期ШA族元素为Al;
C.原子核外L层电子数为K层电子数的3倍,则为O元素;
D.第16号元素为S,
非金属性越强,对应单质的氧化性越强,显然O元素的非金属性最强,则氧气的氧化性最强,
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握原子结构推断元素、元素的性质为解答的关键,侧重分析与应用能力的考查,注意周期律的应用,题目难度不大.

练习册系列答案
相关题目
12.X、Y是元素周期表ⅦA族中的两种元素.下列叙述中能说明X的原子得电子能力比Y强的是( )
| A. | X原子的电子层数比Y原子电子层数多 | |
| B. | X的氢化物的沸点比Y的氢化物沸点低 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
9.下列离子方程式正确的是( )
| A. | NaHS溶液水解的方程式为:HS-+H2O?S2-+H3O+ | |
| B. | 向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| C. | 在100 mL 2 mol/L FeI2溶液中通入4.48 L氯气(标况下),充分反应:2I-+Cl2═I2+2Cl- | |
| D. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ |
16.如图为反应H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法不正确的是( )
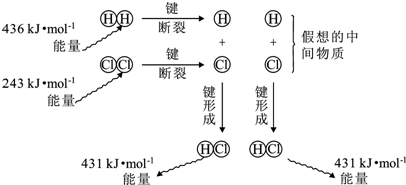

| A. | H-H键比Cl-Cl键强,H-Cl键是极性共价键 | |
| B. | 断键吸收能量,成键释放能量,该反应△H=-183kJ/mol | |
| C. | 若生成液态HCl,则反应释放的能量将减少 | |
| D. | 反应的焓变与假想的中间物质的种类、状态无关 |
6.已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
无水乙醇性质如表:
甲、乙同学用下列实验装置制备乙烯并验证其性质.(气密性已检验,部分夹持装置略).
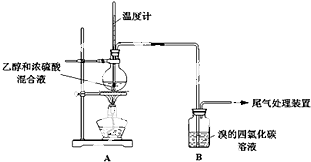
实验操作和现象:
(1)写出乙烯的1个用途:制塑料,对应方程式为(注明反应类型)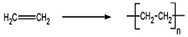 ,加聚反应.
,加聚反应.
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型)CH2=CH2+Br2→CH2BrCH2Br,加成反应.
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是SO2(填化学式).
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
请回答下列问题:
D中盛放的试剂是NaOH(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释):5C2H4+4MnO4-+12H+→10CO2↑+4Mn2++16H2O.
无水乙醇性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
| 无水乙醇 | -114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |

实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
 ,加聚反应.
,加聚反应.(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型)CH2=CH2+Br2→CH2BrCH2Br,加成反应.
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是SO2(填化学式).
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
| 设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
D中盛放的试剂是NaOH(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释):5C2H4+4MnO4-+12H+→10CO2↑+4Mn2++16H2O.
13.碘酸钙[Ca(IO3)2]是-种食品添加剂,以KCLO3、I2为原料,采用如下图所示的流程可制备碘酸钙.
下列有关说法正确的是( )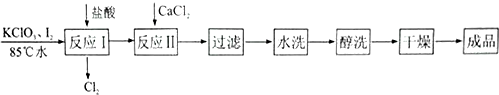
下列有关说法正确的是( )

| A. | “反应I”中主要反应的离子方程式为CIO3-+5CL-+6H+=3CL2↑+3H20 | |
| B. | “反应I”适宜在水浴加热的条件下进行 | |
| C. | 进行“反应Ⅱ”之前需向溶液中滴加过量K2C03溶液除去其中的盐酸 | |
| D. | “醇洗”的目的是为了除去产品中某些不溶性杂质 |
10.苯加溴水后,振荡,溴水层颜色变浅,这是由于( )
| A. | 溴挥发了 | B. | 发生了取代反应 | ||
| C. | 苯萃取了溴水中的溴 | D. | 发生了加成反应 |
11.写出下列基团的名称:
 | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH |