题目内容
16.如图为反应H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法不正确的是( )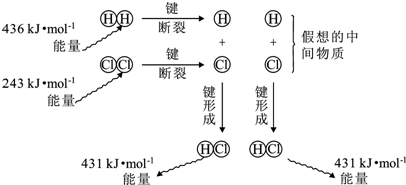
| A. | H-H键比Cl-Cl键强,H-Cl键是极性共价键 | |
| B. | 断键吸收能量,成键释放能量,该反应△H=-183kJ/mol | |
| C. | 若生成液态HCl,则反应释放的能量将减少 | |
| D. | 反应的焓变与假想的中间物质的种类、状态无关 |
分析 A.键能越大,键越强,不同非金属元素之间形成极性键;
B.△H=反应物的总键能-生成物的总键能;
C.从气态到液态会放出热量;
D.焓变只与反应的始态和终态有关.
解答 解:A.氢气键能为436KJ/mol,氯气键能为243KJ/mol,所以H-H键比Cl-Cl键强,不同非金属元素之间形成极性键,即H-Cl键为极性键,故A正确;
B.△H=反应物的总键能-生成物的总键能=(436kJ/mol+243kJ/mol)-2×431kJ/mol=-183kJ/mol,故B正确;
C.从气态到液态会放出热量,所以若生成液态HCl,则反应释放的能量将增大,故C错误;
D.焓变只与反应的始态和终态有关,而与反应的途径无关,即反应的焓变与假想的中间物质的种类、状态无关,故D正确.
故选C.
点评 本题考查了键能与反应热,题目难度不大,注意从键能角度计算反应热的方法,学习中注意相关知识的积累,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 80mL10mol/L的浓盐酸与足量的MnO2加热反应,产生Cl2分子数约为0.2NA | |
| B. | 一定条件下,将1molN2和3molH2混合,充分反应后转移电子数为6NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 常温常压下,等质量的CO和N2中含有原子数目均为2NA |
7.关于下列各图的叙述正确的是( )

| A. | 甲中△H1=-(△H2+△H3) | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH |
1.下列四种元素中,单质的氧化性最强的是( )
| A. | 原子最外层电子数为次外层电子数的2倍 | |
| B. | 第三周期ШA族元素 | |
| C. | 原子核外L层电子数为K层电子数的3倍 | |
| D. | 第16号元素 |
5.下列晶体熔化时不需破坏化学键的是( )
| A. | 晶体硅 | B. | 二氧化硅晶体 | C. | 干冰 | D. | 金属钾 |
6.下列叙述错误的是( )
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应达到平衡状态时,正、逆反应速率相等 | |
| C. | 化学反应达到平衡状态与时间的长短无关 | |
| D. | 化学平衡状态是不可改变的 |
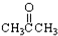 ③CH3CH2Br ④
③CH3CH2Br ④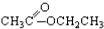 ⑤
⑤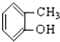 ⑥
⑥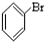 ⑦
⑦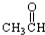 ⑧
⑧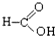 ⑨
⑨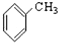 ⑩
⑩
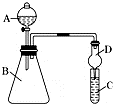 某同学欲利用图装置验证同主族元素性质递变规律.
某同学欲利用图装置验证同主族元素性质递变规律.