题目内容
19.下列说法正确的是( )| A. | 实验室可以用酒精或CS2清洗残留的S | |
| B. | 除去CO2中SO2可以用碳酸钠溶液 | |
| C. | 可以用硝酸酸化的氯化钡检验硫酸根离子 | |
| D. | CO2通入到BaCl2溶液中,溶液不变浑浊 |
分析 A.硫难溶于水,微溶于酒精,易溶于CS2;
B.CO2和SO2都可与Na2CO3溶液反应;
C.可能生成AgCl沉淀;
D.盐酸的酸性大于碳酸.
解答 解:A.硫难溶于水,微溶于酒精,易溶于CS2,不能用酒精清洗,故A错误;
B.CO2和SO2都可与Na2CO3溶液反应,不能用于除杂,故B错误;
C.不能排除Ag+或SO32-离子的影响,可先加盐酸,如无现象,再加氯化钡检验,如生成沉淀,可证明含有SO42-,故C错误;
D.盐酸的酸性大于碳酸,则二氧化碳通入氯化钡溶液中不反应,无现象,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的除杂、检验等知识,为高考常见题型,侧重于学生的分析能力能力和实验能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
6.某酸性工业废水,可能含有Fe3+、Fe2+、Cu2+、Ca2+、Cl-、NO3-、Br-、I-中的一种或几种,为了能回收其中的某些成分,进行了以下实验: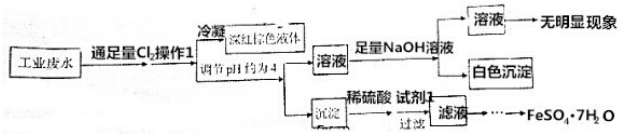
已知pH=4时,Fe3+沉淀完全,而Cu2+、Ca2+未沉淀.
下列说法不正确的是( )

已知pH=4时,Fe3+沉淀完全,而Cu2+、Ca2+未沉淀.
下列说法不正确的是( )
| A. | 该工业废水中肯定存在Cu2+、I- | |
| B. | 若废水中存在NO3-,则肯定存在Fe3+ | |
| C. | 操作1为鼓入热空气,试剂1为Fe | |
| D. | 为了得到FeSO4•7H2O,需要经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥 |
10.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4.则下列说法正确的是( )
| A. | 气态氢化物的稳定性:HX<H2Y<ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 离子半径:X->Y2->Z3- | D. | 原子序数:Z>Y>X |
7.实验室中可用KMnO4来制备氧气.KMnO4中Mn元素的化合价为( )
| A. | +7 | B. | +5 | C. | +1 | D. | -1 |
14.现有三种可溶性物质A、B、C,其中A、B是盐,C是碱,它们溶于水后电离产生的所有离子如下表所示:
回答下列问题:
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则NA个X分子的质量为44,该反应的离子方程式为2H++CO32-=H2O+CO2↑.
(3)A、B溶液分别与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别B溶液中溶质电离m的阴离子的试剂为盐酸、BaCl2溶液.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++H2O+CO2↑.
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下的体积为bL,则E在混合物中的质量分数的表达式为$\frac{a-\frac{197V}{22.4}}{a}$×100%.
| 阳离子 | Na+ | H+ | Ba2+ |
| 阴离子 | OH- | CO32- | SO42- |
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则NA个X分子的质量为44,该反应的离子方程式为2H++CO32-=H2O+CO2↑.
(3)A、B溶液分别与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别B溶液中溶质电离m的阴离子的试剂为盐酸、BaCl2溶液.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++H2O+CO2↑.
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下的体积为bL,则E在混合物中的质量分数的表达式为$\frac{a-\frac{197V}{22.4}}{a}$×100%.
9.下列有关化学用语正确的是( )
| A. | CO2的电子式: | B. | Cl-的结构示意图: | ||
| C. | HCl的结构式: | D. | 质量数为37的氯原子:17 37Cl |
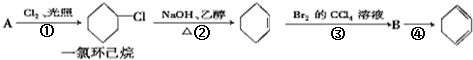
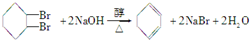 .
.

 .
.