题目内容
10.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4.则下列说法正确的是( )| A. | 气态氢化物的稳定性:HX<H2Y<ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 离子半径:X->Y2->Z3- | D. | 原子序数:Z>Y>X |
分析 同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,根据酸性相对强弱:HXO4>H2YO4>H3ZO4,可知原子序数的关系为X<Y<Z,根据同周期非金属性的递变规律比较.
解答 解:同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,
A、非金属性越强,则对应氢化物的稳定性越强,则气态氢化物的稳定性:HX>H2Y>ZH3,故A错误;
B、根据酸性相对强弱:HXO4>H2YO4>H3ZO4,则可知非金属性X>Y>Z,故B错误;
C、电子层结构相同核电荷数越大半径越小,所以离子半径:X->Y2->Z3-,故C正确;
D、同周期非金属性X>Y>Z,可知原子序数的关系为X<Y<Z,故D错误;
故选C.
点评 本题考查元素周期律的递变规律,题目难度不大,注意判断非金属性强弱的角度和方法.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
1.下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)上述反应中,反应物的总能量比生成物的总能量高(选填“高”、“低”或“相等”).
(2)实验l、2可得出的结论是反应物浓度越大,反应速率越快;实验3、4可得出的结论是反应温度越高,反应速率越快.
(3)若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡.该金属的金属活动性比铁强(选填“强”或“弱”),铁电极上发生的电极反应式为2H++2e-=H2↑.
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | V(H2SO4) mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.7 | 50 | 20 | 35 | 250 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
(1)上述反应中,反应物的总能量比生成物的总能量高(选填“高”、“低”或“相等”).
(2)实验l、2可得出的结论是反应物浓度越大,反应速率越快;实验3、4可得出的结论是反应温度越高,反应速率越快.
(3)若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡.该金属的金属活动性比铁强(选填“强”或“弱”),铁电极上发生的电极反应式为2H++2e-=H2↑.
5.下列有关燃料电池的说法正确的是( )
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 氢氧燃料电池工作时氢气在正极被氧化 | |
| D. | 以KOH溶液为电解质溶液的氢氧燃料电池,正极反应为O2+2H2O+4e-=4OH- |
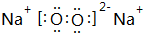
15.下列化学用语对应正确的是( )
| A. | NH4Cl的电子式: | B. | 甲烷的结构式: | C. | H2O2的电子式: | D. | CCl4的电子式: |
2.分子式为C 8H 10的某有机物,可能属于何种类别( )
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |
19.下列说法正确的是( )
| A. | 实验室可以用酒精或CS2清洗残留的S | |
| B. | 除去CO2中SO2可以用碳酸钠溶液 | |
| C. | 可以用硝酸酸化的氯化钡检验硫酸根离子 | |
| D. | CO2通入到BaCl2溶液中,溶液不变浑浊 |
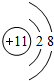
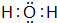 、
、 .
.