题目内容
Ⅰ.已知:4Al(s)+3O2(g)=2Al2O3(s)△H=-2834.9KJ?mol-1
Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=+234.1KJ?mol-1
C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1
写出铝与氧化铁发生铝热反应的热化学方程式 .
Ⅱ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)△H<0 体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K= ; 用O2表示从0~2s内该反应的平均速率ν(O2)= .
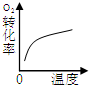
(2)下列研究目的和示意图相符的是 .
Ⅲ.科学家制造出一种使用固体电解质的高效燃料电池.一个电极通入空气,另一个电极通入燃料蒸汽.其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子(其中氧化反应发生完全).以丙烷(C3H8)代表燃料.
(1)电池的负极反应式为 ;
(2)放电时固体电解质里的O2-离子向 极移动(填“正”或“负”).
Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1
写出铝与氧化铁发生铝热反应的热化学方程式
Ⅱ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)△H<0 体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)下列研究目的和示意图相符的是
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |
 |
 |
 |
(1)电池的负极反应式为
(2)放电时固体电解质里的O2-离子向
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:Ⅰ根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也对应相应的系数进行加减,构造目标热化学方程式;
Ⅱ(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;由表中数据可计算用NO表示速率,根据速率关系可计算出用氧气表示的速率;
(2)A、此反应是气体体积缩小的反应,则利用压强对化学平衡及化学反应速率的影响,然后结合图象来分析;
B、该反应是放热反应,利用温度对化学平衡的影响及图象来分析;
C、利用增大反应物的浓度对化学平衡移动的影响并结合图象来分析;
D、利用催化剂对化学反应速率及化学平衡的影响,结合图象来分析;
Ⅲ(1)固体电解质的燃料电池,通入空气的电极反应为O2+4e-=2O2-,汽油在负极发生氧化反应;
(2)原电池工作时,阴离子向负极移动,阳离子向正极移动.
Ⅱ(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;由表中数据可计算用NO表示速率,根据速率关系可计算出用氧气表示的速率;
(2)A、此反应是气体体积缩小的反应,则利用压强对化学平衡及化学反应速率的影响,然后结合图象来分析;
B、该反应是放热反应,利用温度对化学平衡的影响及图象来分析;
C、利用增大反应物的浓度对化学平衡移动的影响并结合图象来分析;
D、利用催化剂对化学反应速率及化学平衡的影响,结合图象来分析;
Ⅲ(1)固体电解质的燃料电池,通入空气的电极反应为O2+4e-=2O2-,汽油在负极发生氧化反应;
(2)原电池工作时,阴离子向负极移动,阳离子向正极移动.
解答:
解:Ⅰ已知:①4Al(s)+3O2(g)=2Al2O3(s)△H=-2834.9KJ?mol-1
②Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=+234.1KJ?mol-1
③C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1
由盖斯定律可知,②-③×
+①×
得:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)
△H=234.1KJ/mol-
×(-393.5KJ/mol)+
×(-2834.9KJ/mol)=-593.1KJ?mol-1;
故答案为:2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-593.1KJ?mol-1;
Ⅱ(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,本反应中K=
,0~2s内v(NO)=0.0
mol/(L?s)=0.003mol/(L?s);v(O2)=
v(NO)=0.0015mol/(L?s);
故答案为:
;0.0015mol/(L?s);
(2)A、该反应中增大压强平衡向正反应方向移动,则NO2的体积分数增大,与图象不符,故A错误;
B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则O2的转化率降低,与图象中转化率增大不符,故B错误;
C、反应平衡后,增大氧气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,
逆反应速率不断增大,直到新的平衡,与图象符合,故C正确;
D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D错误;
故选C;
Ⅲ(1)固体电解质的燃料电池,丙烷燃料电池放电时负极发生的是燃料丙烷失电子的氧化反应,且负极反应=总反应-正极反应,正反应为:
10O2+40e-=20O2-,总反应是:2C3H8+10O2═6CO2+8H2O,所以负极反应是:C3H8+10 O2--20e-=3CO2+4H2O,故答案为:C3H8+10 O2--20e-=3CO2+4H2O;
(2)原电池工作时,阴离子向负极移动,阳离子向正极移动,故答案为:负.
②Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
③C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1
由盖斯定律可知,②-③×
| 3 |
| 2 |
| 1 |
| 2 |
△H=234.1KJ/mol-
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-593.1KJ?mol-1;
Ⅱ(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,本反应中K=
| c2(NO2) |
| c2(NO)?c(O2) |
| 0.01-0.004 |
| 2 |
| 1 |
| 2 |
故答案为:
| c2(NO2) |
| c2(NO)?c(O2) |
(2)A、该反应中增大压强平衡向正反应方向移动,则NO2的体积分数增大,与图象不符,故A错误;
B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则O2的转化率降低,与图象中转化率增大不符,故B错误;
C、反应平衡后,增大氧气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,
逆反应速率不断增大,直到新的平衡,与图象符合,故C正确;
D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D错误;
故选C;
Ⅲ(1)固体电解质的燃料电池,丙烷燃料电池放电时负极发生的是燃料丙烷失电子的氧化反应,且负极反应=总反应-正极反应,正反应为:
10O2+40e-=20O2-,总反应是:2C3H8+10O2═6CO2+8H2O,所以负极反应是:C3H8+10 O2--20e-=3CO2+4H2O,故答案为:C3H8+10 O2--20e-=3CO2+4H2O;
(2)原电池工作时,阴离子向负极移动,阳离子向正极移动,故答案为:负.
点评:本题考查盖斯定律的计算、反应速率、平衡常数计算、化学平衡与图象,原电池工作原理,题目难度中等.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1 mol过氧化钠中阴离子所带的负电荷数为NA |
| B、14 g乙烯和丙烯的混合物中含有的碳原子的数目为NA |
| C、28 g C16O与28 g C18O中含有的质子数均为14 NA |
| D、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA |
如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉现象的是( )
A、 挤压装置的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 |
B、 挤压装置的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 |
C、 用鼓气装置从装置的a处不断鼓入空气并打开止水夹 |
D、 向装置的水槽中慢慢加入足量浓硫酸并打开止水夹 |
NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,5.6 L一氧化氮和5.6L氧气混合后的分子总数为0.5NA |
| B、在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 |
| C、1 mol乙烷分子中含有8NA个共价键 |
| D、58.5 g的氯化钠固体中含有NA个氯化钠分子 |
