题目内容
燃烧法是测定有机化合物化学式的一种重要方法.在一定温度下取0.1mol某有机物与0.2molO2恰好完全反应,生成CO2和水蒸汽,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重8.8g.
(1)通过计算确定该有机物的分子式 .
(2)若该有机物能与Na2CO3溶液反应产生无色无味的气体,则该有机物的结构简式为 .
若该有机物为不易溶于水的油状液体,且有香味,能与NaOH溶液反应,则该有机物的结构简式为 .
(1)通过计算确定该有机物的分子式
(2)若该有机物能与Na2CO3溶液反应产生无色无味的气体,则该有机物的结构简式为
若该有机物为不易溶于水的油状液体,且有香味,能与NaOH溶液反应,则该有机物的结构简式为
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)浓硫酸增重3.6g为生成的水的质量,根据H原子守恒可求得0.1mol有机物中H原子的物质的量,碱石灰增重8.8g为燃烧生成CO2的质量,根据C原子守恒可求得0.1mol有机物中C原子的物质的量,以此可求得烃的分子式;
(2)该有机物能与Na2CO3溶液反应产生无色无味的气体,则含有羧基,酯类物质不易溶于水,可以和氢氧化钠之间反应,根据要求书写结构简式.
(2)该有机物能与Na2CO3溶液反应产生无色无味的气体,则含有羧基,酯类物质不易溶于水,可以和氢氧化钠之间反应,根据要求书写结构简式.
解答:
解:(1)浓硫酸增重3.6g0.2mol为生成的水的量,根据H原子守恒可求得0.1mol有机物中H原子的物质的量是0.4mol,有机物含有氢原子的个数是4,碱石灰增重8.8g(0.2mol)为燃烧生成CO2的质量,根据C原子守恒可求得0.1mol有机物中C原子的物质的量是0.2mol,所以碳原子个数是2,0.2molO2含有氧原子的物质的量是0.4mol;根据氧原子守恒,有机物中氧原子的物质的量是0.2mol+0.4mol-0.4mol=0.2mol,所以有机物中含有氧原子个数是2,有机物的分子式为C2H4O2,
故答案为:C2H4O2;
(2)该有机物能与Na2CO3溶液反应产生无色无味的气体,一定含有羧基,所以有机物的结构简式为:CH3COOH,该有机物为不易溶于水的油状液体,且有香味,能与NaOH溶液反应,则属于酯类,应该是甲酸甲酯,结构简式为:HCOOCH3,故答案为:CH3COOH;HCOOCH3.
故答案为:C2H4O2;
(2)该有机物能与Na2CO3溶液反应产生无色无味的气体,一定含有羧基,所以有机物的结构简式为:CH3COOH,该有机物为不易溶于水的油状液体,且有香味,能与NaOH溶液反应,则属于酯类,应该是甲酸甲酯,结构简式为:HCOOCH3,故答案为:CH3COOH;HCOOCH3.
点评:注意燃烧法确定有机物的分子式中,元素守恒思想的应用,根据物质的性质结合分子式可书写结构简式,难度不大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
A、硫酸铜溶液与氢氧化钡溶液反应:SO
| ||
B、将大理石投入到足量盐酸中:CO
| ||
| C、将Cl2通入KI溶液中:I-+Cl2═Cl-+I2 | ||
| D、向AlCl3溶液中加入过量的氨水反应:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
0.4molMnO2与100mL12mol/L盐酸混合后缓慢加热(不考虑HCl挥发)反应完全后所得溶液中加入足量AgNO3溶液,生成AgCl的物质的量( )
| A、等于0.8mol |
| B、小于0.8mol |
| C、大于0.6mol |
| D、等于0.6mol |
 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )| A、1.0L 1.0mol?L-1H2SO4溶液中,H2SO4分子数为6.02×1023 |
| B、标准状况下,1mol SO3中所含的原子数为 6.02×1023 |
| C、32g S8单质中含有的S-S键个数为6.02×1023 |
| D、22.4L SO2中所含的分子数为6.02×1023 |
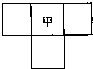 甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.
甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.