题目内容
12.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: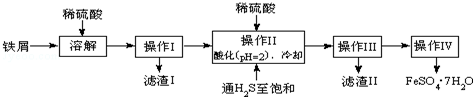
查询资料,得有关物质的数据如下:
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)操作Ⅱ中:
①通入硫化氢至饱和的目的是a除去溶液中的Sn2+离子;b防止Fe2+被氧化;
②在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤、洗涤.
分析 铁屑加入稀硫酸生成硫酸亚铁、硫酸锡,过滤后得到滤液,将滤液加入稀硫酸酸化,并通入硫化氢,可生成SnS沉淀并防止亚铁离子被氧化,过滤后得到滤液为硫酸亚铁,经蒸发浓硫酸、冷却结晶、过滤可得到FeSO4•7H2O,以此解答该题.
解答 解:(1)铁与稀硫酸反应的离子方程式为Fe+2H+=Fe2++H2↑,氧化铁溶解在稀硫酸中的离子反应式为Fe2O3+6H+=2Fe3++3H2O,Fe3+继续溶解铁的离子反应式为2Fe3++Fe=3Fe2+,铁作还原剂的离子方程式为Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+,故答案为:Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+;
(2)①通入硫化氢至饱和除沉淀Sn2+外,因硫化氢具有强还原性,可以防止亚铁离子被氧化,故答案为:防止Fe2+被氧化;
②已知在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,故答案为:防止Fe2+离子生成沉淀;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,
故答案为:蒸发浓缩、冷却结晶.
点评 本题考查了铁盐亚铁盐的性质应用,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目着重于分离混合物的实验方法设计和分析判断的考查,难度中等.

练习册系列答案
相关题目
2.下列变化不能通过一步反应实现的是( )
| A. | SO2→H2SO3 | B. | SiO2→H2SiO3 | C. | SO2→S | D. | S→SO3 |
3.下列离子检验的步骤、现象和结论都正确的是( )
| A. | 向试液中滴加氯化钡溶液,产生白色沉淀,则溶液中一定含有CO32- | |
| B. | 向试液中滴加浓氢氧化钠溶液,加热产生刺激性气味的气体,则溶液中一定含有NH4+ | |
| C. | 向试液中滴加硝酸银溶液,产生白色沉淀,则溶液中一定含有Cl- | |
| D. | 向试液中滴加盐酸,产生的气体能使品红溶液褪色,则溶液中一定含有SO32- |
20.下列叙述正确的是( )
| A. | 固体SiO2一定是晶体 | |
| B. | 晶体有固定的组成,非晶体没有固定的组成 | |
| C. | 晶体内部的微粒按一定规律呈周期性有序排列 | |
| D. | 晶体的基本结构单元(晶胞)全部是平行六面体 |
17.下列实验操作及现象能够达到对应实验目的是( )
| 实验操作及现象 | 实验目的 | |
| A | 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaCO3)>KSP(BaSO4) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
| A. | A | B. | B | C. | C | D. | D |
7.等物质的量的钠、铁、铝分别与足量的盐酸充分反应,在相同的条件下,产生氢气的体积比是( )
| A. | 1:1:1 | B. | 1:3:3 | C. | 1:2:3 | D. | 2:3:3 |
4.下列对同系物归纳错误的是( )
| A. | 同系物都符合同一通式 | |
| B. | 同系物彼此在组成上相差一个或若干个某种原子团 | |
| C. | 同系物具有相同的最简式 | |
| D. | 同系物的结构相似 |
5.工业上生产乙烯、丙烯的主要方法是( )
| A. | 裂化 | B. | 干馏 | C. | 分馏 | D. | 裂解 |