题目内容
下列结论正确的是( )
| A、向氯化铝溶液中滴加过量氨水,反应的离子方程式是:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、足量铜与含1mol溶质的浓硫酸反应,可生成0.5molSO2 |
| C、溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
| D、15.6g过氧化钠与足量二氧化碳充分反应,转移电子数为1.204×1023 |
考点:离子方程式的书写,氧化还原反应的电子转移数目计算,胶体的重要性质
专题:离子反应专题
分析:A.铝离子和一水合氨反应生成氢氧化铝和氯化铵;
B.加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,但稀硫酸和铜不反应;
C.溶液和胶体的本质区别是分散质粒子直径;
D.15.6g过氧化钠的物质的量=
=0.2mol,和二氧化碳反应方程式为2Na2O2+2CO2=2Na2CO3+O2,该反应过氧化钠中O元素化合价由-1价变为0价和-2价,即有一半的过氧化钠作氧化剂、有一半的过氧化钠作还原剂.
B.加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,但稀硫酸和铜不反应;
C.溶液和胶体的本质区别是分散质粒子直径;
D.15.6g过氧化钠的物质的量=
| 15.6g |
| 78g/mol |
解答:
解:A.铝离子和一水合氨反应生成氢氧化铝和氯化铵,离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故A错误;
B.加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,但稀硫酸和铜不反应,所以生成的二氧化硫小于0.5mol,故B错误;
C.溶液和胶体的本质区别是分散质粒子直径,胶体粒子直径在1-100nm之间,故C错误;
D.15.6g过氧化钠的物质的量=
=0.2mol,和二氧化碳反应方程式为2Na2O2+2CO2=2Na2CO3+O2,该反应过氧化钠中O元素化合价由-1价变为0价和-2价,即有一半的过氧化钠作氧化剂、有一半的过氧化钠作还原剂,所以0.2mol过氧化钠完全反应转移电子数=0.2mol×
×2×[0-(-1)]×6.02×1023/mol=1.204×1023,故D正确;
故选D.
B.加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,但稀硫酸和铜不反应,所以生成的二氧化硫小于0.5mol,故B错误;
C.溶液和胶体的本质区别是分散质粒子直径,胶体粒子直径在1-100nm之间,故C错误;
D.15.6g过氧化钠的物质的量=
| 15.6g |
| 78g/mol |
| 1 |
| 2 |
故选D.
点评:本题考查较综合,涉及离子方程式判断、氧化还原反应、溶液和胶体的区别等知识点,综合性较强,知道氢氧化铝能溶于强碱但不溶于弱碱,知道溶液和胶体的本质区别,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
已知CH4、H2O和NH3的物质的量均为1mol,下列说法不正确的是( )
| A、所含分子数之比为1:1:1 |
| B、所含氢原子数之比为4:2:3 |
| C、摩尔质量之比为1:1:1 |
| D、质量之比为16:18:17 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、25℃时,2LpH=1的H2SO4溶液中,SO42-数目为0.1NA | ||
| B、300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | ||
C、标准状况下,V L CHCl3含有的碳原子数为
| ||
| D、1 mol OH-参与电解,反应过程中转移的电子数为NA |
下列反应的离子方程式中正确的是( )
| A、硫酸亚铁溶液中加入用硫酸酸化过的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O |
| B、过量的二氧化硫通入漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3 |
| C、向氯化铝溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
下列说法正确的是( )
A、按系统命名法,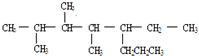 命名为2,3,4-三甲基-5-丙基庚烷 命名为2,3,4-三甲基-5-丙基庚烷 |
| B、邻羟基苯甲醛和对羟基苯甲醛是同分异构体,但邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高 |
C、塑化剂的种类很多,其中一种塑化剂的结构简式如图所示.可知该塑化剂该塑化剂在人体内会彻底水解产生2种有机物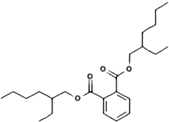 |
D、用甘氨酸(HN2-CH2-COOH)和丙氨酸(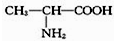 )缩合最多可形成3种二肽 )缩合最多可形成3种二肽 |
在一定温度下,反应A2(气)+B2(气)?2AB(气)达到平衡的标志是( )
| A、单位时间生成n mol的A2同时生成n mol的AB |
| B、容器内的总压强不随时间变化 |
| C、单位时间生成2n mol的AB同时生成n mol的B2 |
| D、单位时间生成n mol的A2同时生成n mol的B2 |