题目内容
 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=
(2)该反应的化学平衡常数K=
T℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中
②反应在4min-5min间,平衡向逆方向移动,可能的原因是
a.加入水蒸气 b.降低温度 c.使用催化剂 d.加入氢气.
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)根据υ=
计算反应速率;先计算出反应消耗的CO的浓度,再根据转化率公式计算;
(2)分别计算各物质的平衡浓度,根据平衡常数表达式计算K;
(3)①表中3min-4min之间各物质的浓度不变,850℃达到平衡,c(CO)=0.08mol/L,该反应为放热反应,升高温度逆向移动;
②反应在4min~5min,平衡向逆方向移动,根据平衡移动原理,结合选项判断;
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,再结合水的浓度变化进行判断.
| △c |
| △t |
(2)分别计算各物质的平衡浓度,根据平衡常数表达式计算K;
(3)①表中3min-4min之间各物质的浓度不变,850℃达到平衡,c(CO)=0.08mol/L,该反应为放热反应,升高温度逆向移动;
②反应在4min~5min,平衡向逆方向移动,根据平衡移动原理,结合选项判断;
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,再结合水的浓度变化进行判断.
解答:
解:(1)υ(H2O)=
=
=0.03mol/(L?min);
0~4min时,消耗的CO的浓度为:0.20mol/L-0.08mol/L=0.12mol/L,则CO的转化率为
×100%=60%;
故答案为:0.03mol/(L?min);60%;
(2)用三段式法计算:
CO(g) 十 H2O(g)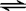 CO2(g)十 H2 (g)
CO2(g)十 H2 (g)
起始:0.20mol/L 0.30mol/L 0 0
转化:0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
平衡:0.08mol/L 0.18mol/L 0.12mol/L 0.12mol/L
则K=
=
=1,
故答案为:1;
(3)①在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡.另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min-4min之间反应应处于平衡状态.由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L.
故答案为:3-4min;大于;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故选d.表中5min-6min之间CO浓度减少,H2O浓度增大,CO2浓度增大,只有增加水蒸气,使化学平衡向正反应方向移动,故选a;
故答案为:d;a.
| △c |
| △t |
| 0.3mol/L-0.18mol/L |
| 4min |
0~4min时,消耗的CO的浓度为:0.20mol/L-0.08mol/L=0.12mol/L,则CO的转化率为
| 0.12 |
| 0.20 |
故答案为:0.03mol/(L?min);60%;
(2)用三段式法计算:
CO(g) 十 H2O(g)
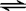 CO2(g)十 H2 (g)
CO2(g)十 H2 (g)起始:0.20mol/L 0.30mol/L 0 0
转化:0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
平衡:0.08mol/L 0.18mol/L 0.12mol/L 0.12mol/L
则K=
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| 0.12mol/L×0.12mol/L |
| 0.08mol/L×0.18mol/L |
故答案为:1;
(3)①在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡.另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min-4min之间反应应处于平衡状态.由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L.
故答案为:3-4min;大于;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故选d.表中5min-6min之间CO浓度减少,H2O浓度增大,CO2浓度增大,只有增加水蒸气,使化学平衡向正反应方向移动,故选a;
故答案为:d;a.
点评:本题综合考查化学平衡常数、平衡的有关计算和判断等问题,题目难度较大,将图表信息和图象信息相结合来分析是解答的关键,较好的考查学生的能力.

练习册系列答案
相关题目
某烃的分子式为C11H16,不能使溴水褪色,但可使酸性高锰酸钾溶液褪色,分子结构中只含有一个烷基,则此烷基的结构共有( )
| A、4种 | B、5种 | C、6种 | D、7种 |

 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空: 实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如图,请回答下列问题:
实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如图,请回答下列问题:
 给你提供纯锌、纯铜片和500ml 0.2mol/L的H2SO4溶液、导线、1000ml量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片和500ml 0.2mol/L的H2SO4溶液、导线、1000ml量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.