题目内容
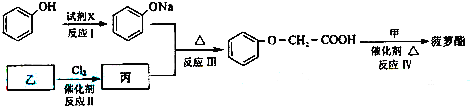
A~J均由短周期元素形成的常见单质或化合物,有如图所示的转化关系.已知C、E、F、G、I为常见气体,C和I都能使石灰水变浑浊,B的焰色反应为黄色.反应条件和部分产物省略.

(1)写化学式:A H I
(2)(NH4)2SO3露置在空气中易变质生成 ,检验变质产物中的阴离子(填操作、现象和结论) .
(3)反应③的离子方程式 .
(4)若反应⑤和⑥都是复分解反应,则J的化学式可能为 (只写一种);若反应⑤和⑥都是氧化还原反应,则反应⑤的化学方程式为 .

(1)写化学式:A
(2)(NH4)2SO3露置在空气中易变质生成
(3)反应③的离子方程式
(4)若反应⑤和⑥都是复分解反应,则J的化学式可能为
考点:无机物的推断,铵盐
专题:推断题
分析:流程分析可知,(NH4)2SO3和B的热溶液反应,B溶液焰色反应为黄色证明含有钠元素,推断B为NaOH溶液,生成的E为NH3,F为NO,G为NO2,H为HNO3,C和I都能使石灰水变浑浊,结合亚硫酸铵的性质可知生成的C为SO2,I为CO2,A为H2SO4,D为SO3,依据推断出的物质回答问题.
解答:
解:依据流程分析可知,(NH4)2SO3和B的热溶液反应,B溶液焰色反应为黄色证明含有钠元素,推断B为NaOH溶液,生成的E为NH3,F为NO,G为NO2,H为HNO3,C和I都能使石灰水变浑浊,结合亚硫酸铵的性质可知生成的C为SO2,I为CO2,A为H2SO4,D为SO3;
(1)上述分析推断可知A为H2SO4,H为HNO3,I为CO2;
故答案为:H2SO4;HNO3;CO2;
(2)(NH4)2SO3露置在空气中易变质,被空气中的氧气氧化生成:(NH4)2SO4,检验变质产物中的阴离子为SO42-,检验阴离子的实验方法为:取少量样品加水溶解,加盐酸酸化,再滴加BaCl2溶液,若产生白色沉淀,证明含SO42-;
故答案为:(NH4)2SO4,取少量样品加水溶解,加盐酸酸化,再滴加BaCl2溶液,若产生白色沉淀,证明含SO42-;
(3)反应③是亚硫酸铵和氢氧化钠加热反应生成氨气的反应,反应的离子方程式NH4++OH-
NH3↑+H2O;
故答案为:NH4++OH-
NH3↑+H2O;
(4)若反应⑤和⑥都是复分解反应,J为碳酸盐金额硫酸、硝酸反应生成二氧化碳气体,如Na2CO3或NaHCO3或Li2CO3或LiHCO3或MgCO3 或BeCO3;若反应⑤和⑥都是氧化还原反应,则是浓硫酸、女学生和碳加热反应生成,反应⑤的化学方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
故答案为:Na2CO3或NaHCO3或Li2CO3或LiHCO3或MgCO3 或BeCO3;C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O.
(1)上述分析推断可知A为H2SO4,H为HNO3,I为CO2;
故答案为:H2SO4;HNO3;CO2;
(2)(NH4)2SO3露置在空气中易变质,被空气中的氧气氧化生成:(NH4)2SO4,检验变质产物中的阴离子为SO42-,检验阴离子的实验方法为:取少量样品加水溶解,加盐酸酸化,再滴加BaCl2溶液,若产生白色沉淀,证明含SO42-;
故答案为:(NH4)2SO4,取少量样品加水溶解,加盐酸酸化,再滴加BaCl2溶液,若产生白色沉淀,证明含SO42-;
(3)反应③是亚硫酸铵和氢氧化钠加热反应生成氨气的反应,反应的离子方程式NH4++OH-
| ||
故答案为:NH4++OH-
| ||
(4)若反应⑤和⑥都是复分解反应,J为碳酸盐金额硫酸、硝酸反应生成二氧化碳气体,如Na2CO3或NaHCO3或Li2CO3或LiHCO3或MgCO3 或BeCO3;若反应⑤和⑥都是氧化还原反应,则是浓硫酸、女学生和碳加热反应生成,反应⑤的化学方程式为:C+2H2SO4(浓)
| ||
故答案为:Na2CO3或NaHCO3或Li2CO3或LiHCO3或MgCO3 或BeCO3;C+2H2SO4(浓)
| ||
点评:本题考查了物质转化关系的分析应用,主要是物质性质和离子性质的分析判断,掌握特征反应条件的转化关系和物质性质是关键,题目中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在给定的四种溶液中,加入以下各种离子后,各离子能在原溶液中大量共存的有( )
| A、滴加酚酞试液显红色的溶液:Fe2+、NH4+、Cl-、I- |
| B、水电离出来的C (H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| C、在C (H+)=10-13mol/L的溶液:K+、SO42-、Al3+、Cl- |
| D、PH=1的溶液:Cu2+、Na+、Mg2+、NO3- |
体积相同、物质的量浓度相同的HCl溶液和CH3COOH溶液分别与NaOH溶液中和时两者消耗的NaOH的物质的量( )
| A、相同 |
| B、中和CH3COOH的多 |
| C、中和HCl的多 |
| D、无法比较 |
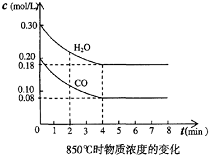 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0 -O-CH2-COOH发生酯化反应的产物.
-O-CH2-COOH发生酯化反应的产物. R-ONa
R-ONa