题目内容
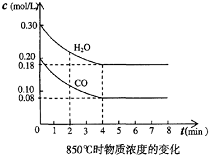
 实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如图,请回答下列问题:
实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如图,请回答下列问题:(1)该反应的化学方程式为
(2)0~5 min钟内,氧气的平均反应速率v (O2)=
(3)0~2 min内v (N2O5)明显大于2~5 min内的v(N2O5),原因是
(4)该反应的平衡常数表达式为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据图中的有关物质的浓度的变化可以判断反应物、生成物,及它们之间量的关系,进而写出化学方程式;
(2)根据v=
求速率;
(3)根据影响速率的因素可判断;
(4)根据化学方程式及平衡常数的定义可写出表达;
(2)根据v=
| △c |
| △t |
(3)根据影响速率的因素可判断;
(4)根据化学方程式及平衡常数的定义可写出表达;
解答:
(1)由图象可知,在5min时,NO2的浓度增加了1.68mol/L,O2的浓度增加了0.42mol/L,N2O5的浓度减小了1-0.16=0.84mol/L,所以NO2、O2为生成物,N2O5为反应物,它们的变化的浓度之比=1.68:0.42:0.84=4:1:2,所以化学反应方程式为:2N2O5?4NO2+O2,
故答案为:2N2O5?4NO2+O2;
(2)v (O2)=
=
=0.084mol/(L?min),故答案为:0.084mol/(L?min);
(3)因为在0~2 min内反应物平均浓度要比2~5 min内的反应物浓度要大,浓度越大反应速率越快,
故答案为:0~2 min内c (N2O5)大于2~5 min内的c(N2O5);
(4)平衡常数是指生成物浓度系数次幂之积与反应物浓度系数次幂之积之比,所以反应2N2O5?4NO2+O2的平衡常数表达式为K=
,
故答案为:
.
故答案为:2N2O5?4NO2+O2;
(2)v (O2)=
| △c(O2) |
| △t |
| 0.42mol/L |
| 5min |
(3)因为在0~2 min内反应物平均浓度要比2~5 min内的反应物浓度要大,浓度越大反应速率越快,
故答案为:0~2 min内c (N2O5)大于2~5 min内的c(N2O5);
(4)平衡常数是指生成物浓度系数次幂之积与反应物浓度系数次幂之积之比,所以反应2N2O5?4NO2+O2的平衡常数表达式为K=
| c4(NO2)?c(O2) |
| c2(N2O5) |
故答案为:
| c4(NO2)?c(O2) |
| c2(N2O5) |
点评:本题考查了学生运用图象写方程式由此求得反应速率、判断影响速率的因素的能力,难度不大.关键是要注意图中的物理量的单位.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
从下列混合物中分离出其中的一种成分,所采取的分离方法正确的是( )
| A、由于碘在酒精中的溶解度大,可以用酒精把碘水中的碘萃取出来 |
| B、水的沸点为100℃,酒精的沸点为78.5℃,所以用加热蒸馏的方法使含水的酒精变为无水酒精 |
| C、由于沙子和水不相溶,因此可用过滤法分离沙子与水的混合物 |
| D、NaCl的溶解度随温度下降而减小,可以用冷却法从热的含少量的KNO3的NaCl浓溶液中分离得到纯净的NaCl |
拆开1mol 共价键所吸收的能量或形成1mol 共价键所释放的能量称为键能.已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,下列说法中正确的是( )
| A、H-H比N≡N更牢固 |
| B、N≡N键能约为946 kJ/mol |
| C、合成氨反应选择适当的催化剂是为了提高H2的转化率 |
| D、0.5mol N2和1.5mol H2在题给条件下充分反应,放出热量为46.2 kJ |
 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
 -O-CH2-COOH发生酯化反应的产物.
-O-CH2-COOH发生酯化反应的产物.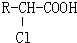 R-ONa
R-ONa