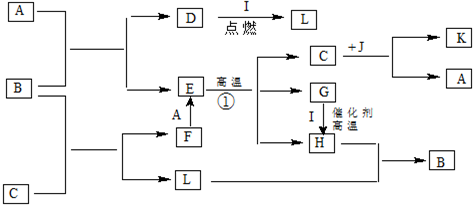
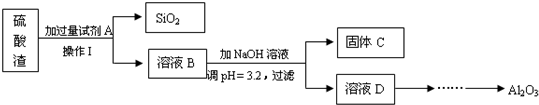
题目内容
已知:
①Zn(s)+
O2(g)═ZnO(s)△H1=-350.5kJ/mol
②HgO(s)═Hg(l)+
O2(g)△H2=+90.8kJ/mol
③Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H3
请回答:
(1)反应①属于 (填“吸热”或“放热”)反应.
(2)反应①消耗65g Zn(s)时,△H= kJ/mol.
(3)反应②生成1mol Hg(l)时,△H= kJ/mol.
(4)反应③的△H3= kJ/mol.
①Zn(s)+
| 1 |
| 2 |
②HgO(s)═Hg(l)+
| 1 |
| 2 |
③Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H3
请回答:
(1)反应①属于
(2)反应①消耗65g Zn(s)时,△H=
(3)反应②生成1mol Hg(l)时,△H=
(4)反应③的△H3=
考点:有关反应热的计算,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:(1)根据热化学方程式中△H的符号判断;
(2)△H的大小与Zn的用量无关;
(3)根据反应②中△H的值计算;
(4)根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
(2)△H的大小与Zn的用量无关;
(3)根据反应②中△H的值计算;
(4)根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
解答:
解:(1)已知①Zn(s)+
O2(g)═ZnO(s)△H1=-350.5kJ/mol,该反应中△H为负值,则该反应属于放热反应,故答案为:放热;
(2)△H的大小与Zn的用量无关,所以反应①消耗65g Zn(s)时,△H的值不变为-350.5kJ/mol,故答案为:-350.5;
(3)已知HgO(s)═Hg(l)+
O2(g)△H2=+90.8kJ/mol,则生成1mol Hg(l)时,△H=+90.8kJ/mol,故答案为:+90.8;
(4)已知:①Zn(s)+
O2(g)=ZnO(s)△H1=-350.5kJ/mol
②HgO(s)═Hg(l)+
O2(g)△H2=+90.8kJ/mol
根据盖斯定律,①+②得Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H3=△H1+△H2=-350.5kJ/mol+90.8kJ/mol=-259.7 kJ/mol,
故答案为:-259.7.
| 1 |
| 2 |
(2)△H的大小与Zn的用量无关,所以反应①消耗65g Zn(s)时,△H的值不变为-350.5kJ/mol,故答案为:-350.5;
(3)已知HgO(s)═Hg(l)+
| 1 |
| 2 |
(4)已知:①Zn(s)+
| 1 |
| 2 |
②HgO(s)═Hg(l)+
| 1 |
| 2 |
根据盖斯定律,①+②得Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H3=△H1+△H2=-350.5kJ/mol+90.8kJ/mol=-259.7 kJ/mol,
故答案为:-259.7.
点评:本题考查盖斯定律、反应热的计算等,难度中等,侧重于考查学生的计算能力和知识的运用能力,注意盖斯定律的理解与运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各装置中,烧杯中盛有海水,能够形成原电池并且铁为正极的是( )
A、 |
B、 |
C、 |
D、 |
关于下列各装置图的叙述中,不正确的是( )
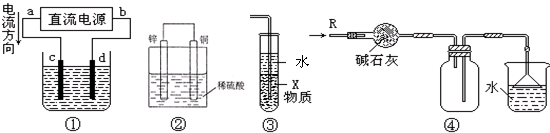

| A、若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B、装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应 |
| C、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
将过量Cl2通入NaBr和NaI的混合液中,然后把混合溶液蒸干,再将剩余残渣灼烧,最后留下的物质( )
| A、NaBr,NaI |
| B、NaCl,NaBr |
| C、NaCl |
| D、NaCl,I2 |
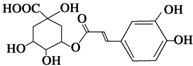 预防和治疗甲型H1N1流感的中草药中都含有金银花.绿原酸是金银花的活性成分之一,具有广泛的抗菌及抗病毒作用.有关绿原酸的说法错误的是( )
预防和治疗甲型H1N1流感的中草药中都含有金银花.绿原酸是金银花的活性成分之一,具有广泛的抗菌及抗病毒作用.有关绿原酸的说法错误的是( )| A、绿原酸的分子式为C16H18O9 |
| B、1 mol绿原酸最多可与5 mol H2发生反应 |
| C、绿原酸中含氧官能团有羧基、羟基和酯基 |
| D、绿原酸酸性条件下水解后所得两产物碳原子数之差为2 |