题目内容
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).
下表列出了相关金属离子生成氢氧化物沉淀的pH:
某同学设计了如下方案,分离样品中各种金属元素,请回答下列问题.
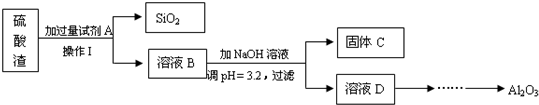
(1)试剂A的化学式: ;固体C的化学式: ;操作I的名称: ;
(2)请你按上述框图形式进一步完成由“溶液D”到“Al2O3”的流程(注明试剂、条件和操作);为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O
(3)若用铁粉还原Fe3+,测得的铁元素的含量 (填“偏大”或“偏小”或“不变”);如何确定Fe3+已全部被还原: ;
(4)判断到达滴定终点的现象是 ;
(5)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL,试样溶液,用1.000×10-2mol/L KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则硫酸渣中铁元素的质量分数是 .
下表列出了相关金属离子生成氢氧化物沉淀的pH:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 2.2 | 3.2 |
| Al3+ | 3.7 | 4.7 |
| Mg2+ | 9.6 | 11.1 |

(1)试剂A的化学式:
(2)请你按上述框图形式进一步完成由“溶液D”到“Al2O3”的流程(注明试剂、条件和操作);为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O
(3)若用铁粉还原Fe3+,测得的铁元素的含量
(4)判断到达滴定终点的现象是
(5)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL,试样溶液,用1.000×10-2mol/L KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则硫酸渣中铁元素的质量分数是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:流程分析:依据废渣溶于过量盐酸得到溶液B中含有溶质为:MgCl2、AlCl3、FeCl3和过量HCl;B溶液中加入氢氧化钠溶液,调节溶液PH=3.2后,生成氢氧化铁沉淀;和滤液MgCl2、AlCl3和过量HCl;在加入过量氢氧化钠溶液,过滤得到滤液中为NaCl,NaAlO2;通入二氧化碳气体生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到Al2O3;
(1)根据废渣主要化学成分中SiO2、Fe2O3、Al2O3和MgO的性质判断应加入过量盐酸或稀硫酸,Fe2O3碱性氧化物,Al2O3两性氧化物、MgO碱性氧化物都溶于过量的酸,只有二氧化硅不溶,经过滤后可分离;根据表中数据可知调节溶液PH=3.2后,生成氢氧化铁沉淀;
(2)依据流程图画出;
(3)若用铁粉还原Fe3+,会引入更多的铁元素,使测得的铁元素的含量偏大;可根据Fe3+的性质确定Fe3+是否已全部被还原;
(4)根据KMnO4标准溶液本身就是一种指示剂;
(5)利用关系式法计算和质量分数的概念来分析.
(1)根据废渣主要化学成分中SiO2、Fe2O3、Al2O3和MgO的性质判断应加入过量盐酸或稀硫酸,Fe2O3碱性氧化物,Al2O3两性氧化物、MgO碱性氧化物都溶于过量的酸,只有二氧化硅不溶,经过滤后可分离;根据表中数据可知调节溶液PH=3.2后,生成氢氧化铁沉淀;
(2)依据流程图画出;
(3)若用铁粉还原Fe3+,会引入更多的铁元素,使测得的铁元素的含量偏大;可根据Fe3+的性质确定Fe3+是否已全部被还原;
(4)根据KMnO4标准溶液本身就是一种指示剂;
(5)利用关系式法计算和质量分数的概念来分析.
解答:
解:依据废渣溶于过量盐酸得到溶液B中含有溶质为:MgCl2、AlCl3、FeCl3和过量HCl;B溶液中加入氢氧化钠溶液,调节溶液PH=3.2后,生成氢氧化铁沉淀;和滤液MgCl2、AlCl3和过量HCl;在加入过量氢氧化钠溶液,过滤得到滤液中为NaCl,NaAlO2;通入二氧化碳气体生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到Al2O3;
(1)废渣主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%);加入过量盐酸或稀硫酸,Fe2O3碱性氧化物,Al2O3两性氧化物、MgO碱性氧化物都溶于过量的酸,只有二氧化硅不溶,经过滤后可分离;根据表中数据可知调节溶液PH=3.2后,生成氢氧化铁沉淀,
故答案为:HCl (H2SO4); Fe(OH)3; 过滤;
(2)依据流程图画出; ,
,
故答案为: ;
;
(3)若用铁粉还原Fe3+,会引入更多的铁元素,使测得的铁元素的含量偏大;可根据Fe3+的性质确定Fe3+是否已全部被还原,
故答案为:偏大;取预处理后的溶液少许,加入KSCN溶液,若不出现血红色,说明Fe3+已全部被还原;
(4)因KMnO4标准溶液本身就是一种指示剂,滴入最后一滴溶液变为紫色;
故答案为:与滴下最后一滴KMnO4标准溶液时,溶液颜色变为紫红色,且在半分钟内不褪色;
(5)利用关系式法计算:
5Fe2+~~~~MnO4-
2×10-5mol 1.000×10-2mol?L-1×0.01L×4
铁元素的质量为:2×10-3mol×56g/mol=0.112 g;
铁元素的质量分数为
×100%=5.6%,
故答案为:5.6%.
(1)废渣主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%);加入过量盐酸或稀硫酸,Fe2O3碱性氧化物,Al2O3两性氧化物、MgO碱性氧化物都溶于过量的酸,只有二氧化硅不溶,经过滤后可分离;根据表中数据可知调节溶液PH=3.2后,生成氢氧化铁沉淀,
故答案为:HCl (H2SO4); Fe(OH)3; 过滤;
(2)依据流程图画出;
 ,
,故答案为:
 ;
;(3)若用铁粉还原Fe3+,会引入更多的铁元素,使测得的铁元素的含量偏大;可根据Fe3+的性质确定Fe3+是否已全部被还原,
故答案为:偏大;取预处理后的溶液少许,加入KSCN溶液,若不出现血红色,说明Fe3+已全部被还原;
(4)因KMnO4标准溶液本身就是一种指示剂,滴入最后一滴溶液变为紫色;
故答案为:与滴下最后一滴KMnO4标准溶液时,溶液颜色变为紫红色,且在半分钟内不褪色;
(5)利用关系式法计算:
5Fe2+~~~~MnO4-
2×10-5mol 1.000×10-2mol?L-1×0.01L×4
铁元素的质量为:2×10-3mol×56g/mol=0.112 g;
铁元素的质量分数为
| 0.112g |
| 2.000g |
故答案为:5.6%.
点评:本题考查了设计流程分离物质,试剂选择和反应现象,反应特征的应用,滴定实验的终点判断,滴定过程的计算应用,题目难度中等.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
在中学化学实验中可用于分离或提纯的方法很多,如蒸馏、结晶、过滤、盐析等,下列各组混合物的分离或提纯选用方法最合适的是( )
| A、除去AgI胶体中混有的I-离子--过滤、洗涤、干燥 |
| B、除去苯中含有的少量苯酚--加入NaOH溶液、分液 |
| C、分离CuSO4?5H2O和BaSO4的混合物--溶解、过滤 |
| D、除去乙酸乙酯中混有的乙酸杂质--加入NaOH溶液、分液 |
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )


| A、该电池不能够在高温下工作 |
| B、电池的负极反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| C、放电过程中,H+从正极区向负极区迁移 |
| D、电池反应,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4L |