题目内容
关于下列各装置图的叙述中,不正确的是( )
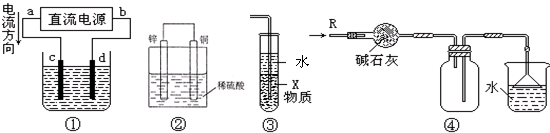

| A、若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B、装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应 |
| C、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
考点:化学实验方案的评价,电解原理
专题:实验评价题
分析:A.装置①精炼铜,由电流方向可知,a为正极,c为阳极;
B.装置②是原电池,Zn为负极;
C.X的密度比水大,不溶于水,可防止倒吸;
D.碱石灰可干燥氨气,氨气利用向下空气法收集,倒扣的漏斗可防止倒吸.
B.装置②是原电池,Zn为负极;
C.X的密度比水大,不溶于水,可防止倒吸;
D.碱石灰可干燥氨气,氨气利用向下空气法收集,倒扣的漏斗可防止倒吸.
解答:
解:A.装置①精炼铜,由电流方向可知,a为正极,c为阳极,则c为粗铜,d为纯铜,电解质溶液为CuSO4溶液,故A错误;
B.装置②是原电池,Zn为负极,发生氧化反应,将化学能转化为电能,故B正确;
C.X的密度比水大,不溶于水,可防止倒吸,则X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸,故C正确;
D.碱石灰可干燥氨气,氨气利用向下空气法收集,倒扣的漏斗可防止倒吸,图中可用于干燥、收集氨气,并吸收多余的氨气,故D正确;
故选A.
B.装置②是原电池,Zn为负极,发生氧化反应,将化学能转化为电能,故B正确;
C.X的密度比水大,不溶于水,可防止倒吸,则X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸,故C正确;
D.碱石灰可干燥氨气,氨气利用向下空气法收集,倒扣的漏斗可防止倒吸,图中可用于干燥、收集氨气,并吸收多余的氨气,故D正确;
故选A.
点评:本题考查化学实验方案的评价,为高频考点,涉及电化学及应用、防止倒吸装置、气体的收集等,侧重有物质性质及化学反应原理的考查,注意实验的评价性、操作性分析,题目难度不大.

练习册系列答案
相关题目
下列溶液中有关物质的量浓度关系和计算不正确的是( )
| A、c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2] |
| B、已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol?L-1 AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol?L-1 |
| C、0.2mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH>1 |
| D、室温下,0.1mol?L-1 NaHA溶液的pH=4,则有C(HA-)>C(H+)>C(A2-)>C(H2A) |
2000K时,反应CO(g)+
O2(g)?CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)?2CO(g)+O2(g)的平衡常数K′为( )
| 1 |
| 2 |
A、
| ||||
| B、K2 | ||||
C、
| ||||
D、
|
在中学化学实验中可用于分离或提纯的方法很多,如蒸馏、结晶、过滤、盐析等,下列各组混合物的分离或提纯选用方法最合适的是( )
| A、除去AgI胶体中混有的I-离子--过滤、洗涤、干燥 |
| B、除去苯中含有的少量苯酚--加入NaOH溶液、分液 |
| C、分离CuSO4?5H2O和BaSO4的混合物--溶解、过滤 |
| D、除去乙酸乙酯中混有的乙酸杂质--加入NaOH溶液、分液 |
下列描述或应用中,正确的是( )
| A、常温常压下,28g N2和CO的混合气体体积为22.4L | ||
| B、任何物质的摩尔质量等于它的相对原子质量或相对分子质量 | ||
C、一个钠原子的质量约为
| ||
| D、CO2的摩尔质量为44g |
下列液体中pH>7的是( )
| A、人体血液 | B、蔗糖溶液 |
| C、可口可乐 | D、胃液 |
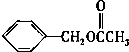 乙酸苯甲酯的结构简式如图,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种( )
乙酸苯甲酯的结构简式如图,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种( )